题目内容
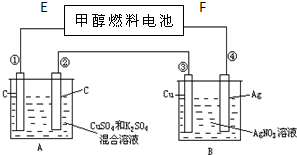 如图所示,用甲醇和氧气以及强碱做电解质溶液的新型燃料电池做电源,对A、B 装置通电一段时间后,发现有1.6g甲醇参加反应且③电极增重(假设工作时无能量损失).请回答下列问题:
如图所示,用甲醇和氧气以及强碱做电解质溶液的新型燃料电池做电源,对A、B 装置通电一段时间后,发现有1.6g甲醇参加反应且③电极增重(假设工作时无能量损失).请回答下列问题:(1)分别指出F电极、②电极的名称
(2)④电极的反应式:
(3)若A池中原混合液的体积为500mL,CuSO4、K2SO4浓度均为0.1mol/L,电解过程中A池中共收集到标准状况下的气体
考点:化学电源新型电池
专题:电化学专题
分析:对A、B装置通电一段时间后,发现有1.6g甲醇参加反应且③电极增重,则说明③电极上银离子得电子析出银,则③是电解池阴极,所以④②是阳极,①是阴极,原电池中E是负极,F是正极,原电池负极上甲醇失电子发生氧化反应,电解池阳极上失电子发生氧化反应,阴极上得电子发生还原反应.
解答:
解:(1)对A、B装置通电一段时间后,发现有1.6g甲醇参加反应且③电极增重,则说明③电极上银离子得电子析出银,则③是电解池阴极,所以④②是阳极,①是阴极,原电池中E是负极,F是正极,故答案为:正极;阳极;
(2)电解池中,③上银离子得电子生成银单质,④电极上银失电子生成银离子进入溶液,电极反应式为:Ag-e-=Ag+,E是原电池负极,负极上甲醇失电子和氢氧根离子生成碳酸根离子和水,电极反应式为:CH3OH+8OH--6e-═CO32-+6H2O,A装置中,①是阴极,该电极上先是铜离子得电子而析出,后氢离子得电子析出氢气,
故答案为:Ag-e-=Ag+;CH3OH+8OH--6e-═CO32-+6H2O;
(3)设1.6g甲醇反应转移电子的物质的量是x,
CH3OH+8OH--6e-═CO32-+6H2O 转移电子
32g 6mol
1.6g x
x=
=0.3mol
若A池中原混合液的体积为500mL,CuSO4、K2SO4浓度均为0.1mol/L,则铜离子的物质的量为0.1mol/L×0.5L=0.05mol,当铜离子完全析出时,铜离子得到电子的物质的量=0.05mol×2=0.1mol<0.3mol,所以电解混合溶液时,阴极上先析出铜后析出氢气,阳极上析出氧气,但得失电子的物质的量都是0.3mol,
设阴极上析出氢气的物质的量是y,阳极上析出氧气的物质的量是z,
则0.05mol×2+2y=4z=0.3mol,y=0.1mol,z=0.075mol,所以A池中共收集到的气体的物质的量是(0.1+0.075)mol=1.75mol,则气体体积=0.175mol×22.4L/mol=3.92L,①上铜离子得电子析出金属铜,铜离子的物质的量为0.1mol/L×0.5L=0.05mol,③上银离子得电子生成银单质,根据电子守恒,转移0.3mol电子析出金属银是0.3mol,两个电极析出固体物质的量之比为1:6,故答案为:3.92; 1:6.
(2)电解池中,③上银离子得电子生成银单质,④电极上银失电子生成银离子进入溶液,电极反应式为:Ag-e-=Ag+,E是原电池负极,负极上甲醇失电子和氢氧根离子生成碳酸根离子和水,电极反应式为:CH3OH+8OH--6e-═CO32-+6H2O,A装置中,①是阴极,该电极上先是铜离子得电子而析出,后氢离子得电子析出氢气,
故答案为:Ag-e-=Ag+;CH3OH+8OH--6e-═CO32-+6H2O;
(3)设1.6g甲醇反应转移电子的物质的量是x,
CH3OH+8OH--6e-═CO32-+6H2O 转移电子
32g 6mol
1.6g x
x=
| 1.6g×6mol |
| 32g |
若A池中原混合液的体积为500mL,CuSO4、K2SO4浓度均为0.1mol/L,则铜离子的物质的量为0.1mol/L×0.5L=0.05mol,当铜离子完全析出时,铜离子得到电子的物质的量=0.05mol×2=0.1mol<0.3mol,所以电解混合溶液时,阴极上先析出铜后析出氢气,阳极上析出氧气,但得失电子的物质的量都是0.3mol,
设阴极上析出氢气的物质的量是y,阳极上析出氧气的物质的量是z,
则0.05mol×2+2y=4z=0.3mol,y=0.1mol,z=0.075mol,所以A池中共收集到的气体的物质的量是(0.1+0.075)mol=1.75mol,则气体体积=0.175mol×22.4L/mol=3.92L,①上铜离子得电子析出金属铜,铜离子的物质的量为0.1mol/L×0.5L=0.05mol,③上银离子得电子生成银单质,根据电子守恒,转移0.3mol电子析出金属银是0.3mol,两个电极析出固体物质的量之比为1:6,故答案为:3.92; 1:6.
点评:本题考查了原电池和电解池原理,注意(4)题中,阴极上不仅析出铜还析出氢气,根据阴极上得到电子数等于原电池中转移电子数进行计算,从而得出析出氢气的量,为易错点.

练习册系列答案
相关题目
与100mL 0.1mol/L (NH4)2SO4溶液中c(NH4+)基本相同的是( )
| A、200 mL 0.1 mol/L NH4Cl 溶液 |
| B、50 mL 0.2 mol/L NH4NO3溶液 |
| C、100 mL 0.2 mol/L NH4HSO4 |
| D、50 mL 0.2 mol/L氨水 |
若NA为阿伏加德罗常数的值.参阅表中数据,下列判断在标准状况下正确的是( )
| ℃ | NO2 | HF |
| 熔点 | -11.2 | -83.6 |
| 沸点 | 21.0 | 19.52 |
| A、20.0 gHF中含σ键数目为1.0NA |
| B、将22.4LNH3溶于1L水中,溶液含有OH-数目为0.1NA |
| C、6.72 LNO2与水反应后,转移的电子数为0.2NA |
| D、H2S和SO2各0.l mol反应后,体系中的S原子数目小于0.2NA |
A、B、C、D为短周期主族元素,且原子序数依次增大.已知A原子的最外层电子数是其电子层数的2倍,B是地壳中含量最多的元素,B原子的最外层电子数是D原子最外层电子数的2倍,C原子最外层只有一个电子.下列说法正确的是( )
| A、原子半径:C>D>A>B |
| B、A的氧化物一定为酸性氧化物 |
| C、元素B和C只能形成一种化合物 |
| D、A、C、D的最高价氧化物对应的水化物均能两两相互反应 |
绿色植物是空气天然的“净化器”,研究发现,1亩柳杉每天可以吸收5mol SO2.则1亩柳杉每天吸收的SO2的质量为( )
| A、320g | B、160g |
| C、64g | D、32g |
下列说法正确的是( )
| A、氨气是非电解质,氨水是电解质 |
| B、氢氧化铁胶体可以发生丁达尔现象 |
| C、摩尔和物质的量均是联系宏观和微观数量的物理量 |
| D、二氧化硅既可和酸又可和碱反应,所以二氧化硅是两性氧化物 |
 和
和