题目内容
2.X元素能形成H2X和XO2两种化合物,该元素的原子序数是( )| A. | 13 | B. | 14 | C. | 15 | D. | 16 |
分析 X元素在H2X中呈-2价,在XO2中呈+4价,根据选项中元素的化合价分析.
解答 解:A.13号元素为Al,没有负价,故A错误;
B.14号元素为Si元素,其负价为-4价,故B错误;
C.15号元素为P元素,其负价为-3价,故C错误;
D.16号元素为S,其化合物为-2、+4价,故D正确.
故选D.
点评 本题考查原子结构与元素性质,难度不大,注意题目中氧化物RO2不一定是最高价氧化物.

练习册系列答案
相关题目
12.下列各种物质在一定条件下反应,所得产物种类与反应物的用量或条件无关的是( )
①Fe+O2
②Na2SiO3+CO2+H2O
③NH4HCO3+NaOH
④Cu+Cl2
⑤Ca(HCO3)2+Ca(OH)2.
①Fe+O2
②Na2SiO3+CO2+H2O
③NH4HCO3+NaOH
④Cu+Cl2
⑤Ca(HCO3)2+Ca(OH)2.
| A. | ④⑤ | B. | ②③ | C. | ①⑤ | D. | ①②⑤ |
13.铝能用于冶炼一些金属(如:钒、铬、锰等),这是因为铝( )
| A. | 具有较强的还原性 | B. | 既能与酸反应,又能与碱反应 | ||
| C. | 熔点低 | D. | 导电性好 |
17.在同温同压下,3体积气体A2和1体积气体B2完全反应后生成2体积气体C,则C的化学式是( )
| A. | A2B3 | B. | A6B | C. | AB3 | D. | A3B |
7.向含1molNaHCO3的溶液中逐滴加入含bmolCa(OH)2的溶液,充分反应.下列说法不正确的是( )
| A. | 滴加Ca(OH)2立即有沉淀生成 | |
| B. | 当b=0.5mol时,发生的离子反应:HCO${\;}_{3}^{-}$+OH-+Ca2+=CaCO3↓+H2O | |
| C. | 当b=1mol时,反应后的溶液中几乎不存在Ca2+ | |
| D. | 当b=1.5mol时,往溶液中再通入少量CO2,还会有沉淀生成 |
14.下列合成高分子化合物的化学方程式中,错误的是不考虑反应条件( )
| A. | nCH2=CHCH2COOH→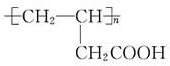 | |
| B. | nHOOC(CH2)5OH?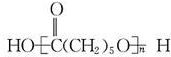 +(n-1)H2O +(n-1)H2O | |
| C. | n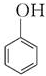 +nHCHO$\stackrel{H+}{→}$ +nHCHO$\stackrel{H+}{→}$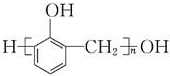 +(2n-1)H2O +(2n-1)H2O | |
| D. | nHOOC(CH2)4COOH+nHO(CH2)2OH?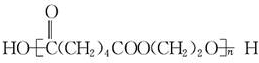 +(2n-1)H2O +(2n-1)H2O |
17.当光束通过下列分散系时,能观察到丁达尔效应的是( )
| A. | 白酒 | B. | 稀豆浆 | C. | 食盐水 | D. | 白糖水 |

 如图是A分子的球棍模型和B分子的比例模型,回答下列问题:
如图是A分子的球棍模型和B分子的比例模型,回答下列问题: