题目内容
已知2H2S+SO2═3S↓+2H2O.
(1)请用双线桥法标出上述方程式的电子转移方向和数目 .
(2) 是还原剂, 是还原产物.
(3)若转移4mol电子,则消耗的H2S在标准状况下的体积为 .
(1)请用双线桥法标出上述方程式的电子转移方向和数目
(2)
(3)若转移4mol电子,则消耗的H2S在标准状况下的体积为
考点:氧化还原反应,氧化还原反应的电子转移数目计算
专题:氧化还原反应专题
分析:反应2H2S+SO2═3S↓+2H2O中硫元素的化合价变化为:由+4价、-2价分别变为0价,该反应中氧化产物和还原产物都是硫单质,结合硫单质和转移电子之间的关系式进行计算.
解答:
解:(1)反应中H2S中S氧化化合价升高,由-2价升高到0价,SO2中S元素化合价降低,由+4价降低到0价,氧化还原反应反应中得失电子数目相等,表现为化合价升降的总数相等,为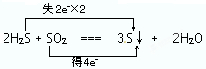 ,故答案为:
,故答案为: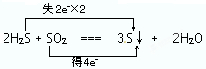 ;
;
(2)反应中H2S被氧化,为还原剂,S既是氧化产物也是还原产物,故答案为:H2S;S;
(3)反应中S元素化合价由-2价升高到0价(+4价降低到0价),由方程式可知,若转移4mol电子,消耗2molH2S,在标准状况下的体积为为2mol×22.4L/mol=44.8L,
故答案为:44.8L.
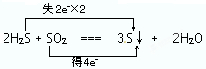 ,故答案为:
,故答案为: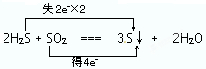 ;
;(2)反应中H2S被氧化,为还原剂,S既是氧化产物也是还原产物,故答案为:H2S;S;
(3)反应中S元素化合价由-2价升高到0价(+4价降低到0价),由方程式可知,若转移4mol电子,消耗2molH2S,在标准状况下的体积为为2mol×22.4L/mol=44.8L,
故答案为:44.8L.
点评:本题考查较为综合,全面考查氧化还原反应知识,注意把握元素化合价的变化,明确电子转移的数目和方向,根据化合价的升降总数计算电子转移的数目,题目难度中等.

练习册系列答案
 天天练口算系列答案
天天练口算系列答案
相关题目
在下列各溶液中,离子一定能大量共存的是( )
| A、强碱性溶液中:K+、Al3+、Cl-、SO42- |
| B、Al3+、NO3-、Cl-、CO32-、Na+可以大量共存于pH=2的溶液中 |
| C、0.1 mol?L-1 NaAlO2溶液:H+、Na+、SO42-、Cl- |
| D、室温下,pH=1的溶液中:Na+、Fe3+、NO3-、SO42- |
对滴有酚酞试液的下列溶液,操作后颜色变深的是( )
| A、明矾[KAl(SO4)2?12H2O]溶液加热 |
| B、CH3COONa溶液加热 |
| C、氨水中加入少量NH4Cl |
| D、小苏打溶液中加入少量的NaCl固体 |
将氯化钾溶液和溴化钾溶液混合,其中有溶质13.400g,溶液体积为500mL,通入氯气充分反应后,将溶液蒸干,得固体物11.175g,则原溶液中K+、Cl-、Br-物质的量之比为( )
| A、3:2:1 |
| B、1:2:3 |
| C、1:3:2 |
| D、2:3:1 |
下列有关氧化还原反应的判断中正确的是( )
| A、金属单质与盐溶液不一定发生置换反应 |
| B、侯氏制碱法的原理属于氧化还原反应 |
| C、阳离子只有氧化性,阴离子只有还原性 |
| D、失电子的数目越多,说明该物质的还原性越强 |
下列叙述中正确的是( )
| A、一摩尔碳 |
| B、1molH+ |
| C、1mol氧含6.02×1023个O2分子 |
| D、硫酸的摩尔质量是98 |
 如图示是元素周期表的一部分,A、B、C均为短周期元素,A、C两种元素的原子核外电子数之和等于B的质子数,B的原子核内质子数和中子数相等.回答:
如图示是元素周期表的一部分,A、B、C均为短周期元素,A、C两种元素的原子核外电子数之和等于B的质子数,B的原子核内质子数和中子数相等.回答: