题目内容
8.把一小粒金属钠放入足量的硫酸铜溶液中.下列物质中属于该反应最终产物的是( )| A. | Cu | B. | Cu(OH)2 | C. | CuO | D. | NaOH |
分析 钠投入到硫酸铜溶液中先与水反应生成氢氧化钠和氢气,氢氧化钠与硫酸铜反应生成氢氧化铜沉淀和硫酸钠,据此解答.
解答 解:把一小粒金属钠放入足量的硫酸铜溶液中,钠先与水反应生成氢氧化钠和氢气,氢氧化钠与硫酸铜反应生成氢氧化铜沉淀和硫酸钠,所以最终生成氢氧化铜沉淀,
故选:B.
点评 本题考查了元素化合物知识,明确钠的性质及钠与盐溶液反应的实质是解题关键,侧重考查学生分析问题能力,题目难度不大.

练习册系列答案
相关题目
5.在强酸性溶液中,可以大量共存的离子是( )
| A. | Na+、K+、SO42-、CO32- | B. | NH4+、Mg2+、SO42-、Cl- | ||
| C. | Na+、K+、HCO3-、Cl- | D. | Na+、K+、AlO2-、NO3- |
19.设NA为阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 标准状况下,5.6L CO2与足量Na2O2反应转移的电子数为0.5NA | |
| B. | 2L 0.5 mol•L-1 亚硫酸溶液中含有的H+数为2NA | |
| C. | 分子总数为NA的SO2和CO2混合气体中含有的氧原子数为2NA | |
| D. | 1mol FeI2与足量氯气反应时转移的电子数为2NA |
3.下列电离方程式中正确的是( )
| A. | KOH═K++OH- | B. | NaHCO3═Na++H++CO32- | ||
| C. | H2SO4═2H++SO42- | D. | Fe2(SO4)3═Fe23++3SO42- |
13.金刚烷的结构如图所示,其二氯代物有(不考虑立体异构)( )


| A. | 5种 | B. | 6种 | C. | 7种 | D. | 8种 |
20.下列反应的离子方程式中,正确的是( )
| A. | 向硝酸银溶液中加盐酸:Ag++Cl-═AgCl↓ | |
| B. | 碳酸氢钙溶液跟盐酸反应:Ca(HCO3)2+2H+═Ca2++2H2O+2CO2↑ | |
| C. | 盐酸跟氢氧化镁反应:H++OH-═H2O | |
| D. | 碳酸镁跟硫酸反应:MgCO3+H+═Mg2++H2O+CO2↑ |
17.NA代表阿伏加德罗常数的值,下列说法正确的是( )
| A. | 16g氧气所含的氧原子数为2NA | |
| B. | 18g水所含的电子数为NA | |
| C. | 2.4g金属镁与盐酸(足量)反应失去的电子数为0.1NA | |
| D. | 17g氨气所含电子数目为10NA |
18.毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2•2H2O的流程如下:
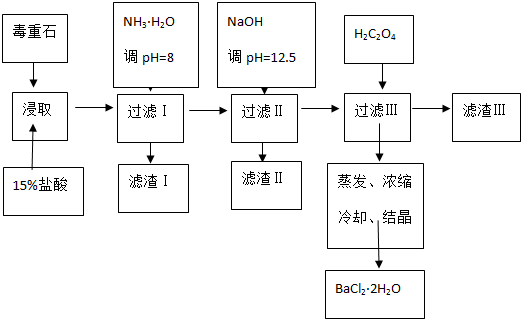
(1)毒重石用盐酸浸取前需充分研磨,目的是增大接触面积从而使反应速率加快.实验室用37%的盐酸配置15%的盐酸,除量筒外还需使用下列仪器中的ac.
a.烧杯 b.容量瓶 c.玻璃棒 d.滴定管
(2)已知:
加入NH3•H2O调节pH=8可除去Fe3+;(填离子符号),滤渣Ⅱ中含Mg(OH)2、Ca(OH)2(填化学式).加入H2C2O4时应避免过量,原因是H2C2O4过量会导致生成BaC2O4沉淀,产品的产量减少.
已知:Ksp(BaC2O4)=1.610-7,Ksp(CaC2O4)=2.310-9
(3)利用间接酸碱滴定法可测定Ba2+的含量,实验分两步进行.
已知:2CrO42-+2H+═Cr2O72-+H20 Ba2++CrO42-═BaCrO4↓
步骤Ⅰ移取xml一定浓度的Na2CrO4溶液与锥形瓶中,加入酸碱指示剂,用bmol•L-1盐酸标准液滴定至终点,测得滴加盐酸体积为V0mL.
步骤Ⅱ:移取y mLBaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol•L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1mL.
试回答:滴加盐酸标准液时应用酸式滴定管,“0”刻度位于滴定管的上方(填“上方”或“下方”).BaCl2溶液的浓度为$\frac{(V{\;}_{0}-V{\;}_{1})b}{y}$mol•L-1,若步骤Ⅱ中滴加盐酸时有少量待测液溅出,Ba2+浓度测量值将偏大(填“偏大”或“偏小”).

(1)毒重石用盐酸浸取前需充分研磨,目的是增大接触面积从而使反应速率加快.实验室用37%的盐酸配置15%的盐酸,除量筒外还需使用下列仪器中的ac.
a.烧杯 b.容量瓶 c.玻璃棒 d.滴定管
(2)已知:
| Ca2+ | Mg2+ | Fe3+ | |
| 开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
| 完全沉淀时的pH | 13.9 | 11.1 | 3.2 |
已知:Ksp(BaC2O4)=1.610-7,Ksp(CaC2O4)=2.310-9
(3)利用间接酸碱滴定法可测定Ba2+的含量,实验分两步进行.
已知:2CrO42-+2H+═Cr2O72-+H20 Ba2++CrO42-═BaCrO4↓
步骤Ⅰ移取xml一定浓度的Na2CrO4溶液与锥形瓶中,加入酸碱指示剂,用bmol•L-1盐酸标准液滴定至终点,测得滴加盐酸体积为V0mL.
步骤Ⅱ:移取y mLBaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol•L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1mL.
试回答:滴加盐酸标准液时应用酸式滴定管,“0”刻度位于滴定管的上方(填“上方”或“下方”).BaCl2溶液的浓度为$\frac{(V{\;}_{0}-V{\;}_{1})b}{y}$mol•L-1,若步骤Ⅱ中滴加盐酸时有少量待测液溅出,Ba2+浓度测量值将偏大(填“偏大”或“偏小”).
 前四周期原子序数依次增大的元素A,B,C,D中,A和B的价电子层中未成对电子均只有1个,且A-和B+的电子相差为8;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2.回答下列问题:
前四周期原子序数依次增大的元素A,B,C,D中,A和B的价电子层中未成对电子均只有1个,且A-和B+的电子相差为8;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2.回答下列问题: .
.