题目内容
已知:甲、乙为气态非金属单质,丙、丁为化合物,其中丙为有刺激性气味的气体,丁在通常状况
下为液体,它们之间的相互转化关系如图1:
请回答:

(1)请写出丙的化学式或电子式 ;并写出丙和氧的反应方程式:
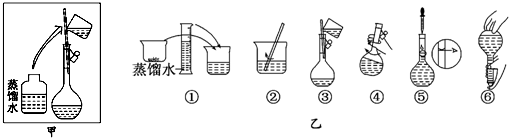
(2)通过如下装置中的可验证丙的还原性.
①请写出反应一段时间后,Ⅰ和Ⅱ装置中可观察到的实验现象和I中所发生反应的化学方程式 .
②图2实验装置由环保角度是否可以改进,请简述理由 .
(3)气体丙与NaClO在溶液中按物质的量比为2:1发生氧化还原反应生成三种化合物.该反应的化学方程式是: .
下为液体,它们之间的相互转化关系如图1:
请回答:

(1)请写出丙的化学式或电子式
(2)通过如下装置中的可验证丙的还原性.
①请写出反应一段时间后,Ⅰ和Ⅱ装置中可观察到的实验现象和I中所发生反应的化学方程式
②图2实验装置由环保角度是否可以改进,请简述理由
(3)气体丙与NaClO在溶液中按物质的量比为2:1发生氧化还原反应生成三种化合物.该反应的化学方程式是:
考点:无机物的推断
专题:推断题
分析:甲、乙为气态非金属单质,丙、丁为化合物,其中丙为有刺激性气味的气体,丁在通常状况下为液体,则丙为NH3,丁为H2O,由相互转化关系图1可知,甲为N2,乙为H2,氨气具有还原性,则图2中,氨气与CuO反应生成Cu、氮气和水,无水硫酸铜变蓝,以此来解答.
解答:
解:甲、乙为气态非金属单质,丙、丁为化合物,其中丙为有刺激性气味的气体,丁在通常状况下为液体,则丙为NH3,丁为H2O,由相互转化关系图1可知,甲为N2,乙为H2,氨气具有还原性,则图2中,氨气与CuO反应生成Cu、氮气和水,无水硫酸铜变蓝,
(1)由上述分析可知,丙为NH3,电子式为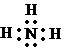 ,丙和氧的反应方程式为4NH3+3O2
,丙和氧的反应方程式为4NH3+3O2
2N2+6H2O,
故答案为:NH3或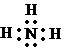 ;4NH3+3O2
;4NH3+3O2
2N2+6H2O;
(2)①I中发生2NH3+CuO
3Cu+N2+3H2O,可观察到黑色粉末变红,试管口部出现无色液滴,II中观察到无水硫酸铜变蓝,(2分)
故答案为:黑色粉末变红,试管口部出现无色液滴,无水硫酸铜变蓝,2NH3+CuO
3Cu+N2+3H2O;
②由环保角度可知,氨气不能排放在环境中,应加装脱氨装置,II后排出的气体中含少量NH3,不吸收会造成污染,
故答案为:加装脱氨装置,II后排出的气体中含少量NH3,不吸收会造成污染;
(3)丙与NaClO在溶液中按物质的量比为2:1发生氧化还原反应生成三种化合物,Cl元素的化合价降低,生成NaCl,N元素的化合价升高,应生成N2H4,由元素守恒可知该反应还生成水,则该反应为2NH3+NaClO=N2H4+NaCl+H2O,故答案为:2NH3+NaClO=N2H4+NaCl+H2O.
(1)由上述分析可知,丙为NH3,电子式为
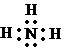 ,丙和氧的反应方程式为4NH3+3O2
,丙和氧的反应方程式为4NH3+3O2
| ||
故答案为:NH3或
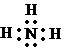 ;4NH3+3O2
;4NH3+3O2
| ||
(2)①I中发生2NH3+CuO
| ||
故答案为:黑色粉末变红,试管口部出现无色液滴,无水硫酸铜变蓝,2NH3+CuO
| ||
②由环保角度可知,氨气不能排放在环境中,应加装脱氨装置,II后排出的气体中含少量NH3,不吸收会造成污染,
故答案为:加装脱氨装置,II后排出的气体中含少量NH3,不吸收会造成污染;
(3)丙与NaClO在溶液中按物质的量比为2:1发生氧化还原反应生成三种化合物,Cl元素的化合价降低,生成NaCl,N元素的化合价升高,应生成N2H4,由元素守恒可知该反应还生成水,则该反应为2NH3+NaClO=N2H4+NaCl+H2O,故答案为:2NH3+NaClO=N2H4+NaCl+H2O.
点评:本题考查无机物的推断,为高频考点,侧重氮及其化合物之间转化的考查,把握“丙为有刺激性气味的气体,丁在通常状况下为液体”为解答的突破口,题目难度不大.

练习册系列答案
相关题目
下列有关实验原理或操作正确的是( )
| A、实验室将硫酸铜溶液直接加热蒸发至干方法来制取CuSO4?5H2O |
| B、用湿润的pH试纸来检验溶液的pH值 |
| C、用KSCN溶液检验硫酸亚铁溶液是否氧化变质 |
| D、用四氯化碳萃取溴的苯溶液中的溴 |
在AlCl3和KCl的混合溶液中,已知Al3+和Cl-的个数比为2:9,则混合物中Al3+和K+的个数比为( )
| A、1:1 | B、1:2 |
| C、2:3 | D、3:4 |
下列物质在溶液中电离出的Cl-与1molCaCl2电离出的Cl-数目相同的是( )
| A、2molKClO3 |
| B、1mol KCl |
| C、2molMgCl2 |
| D、2molNaCl |
 Ⅰ、下列是A、B、C、D、E五种短周期元素的某些性质
Ⅰ、下列是A、B、C、D、E五种短周期元素的某些性质 【化学--物质结构与性质】
【化学--物质结构与性质】