题目内容
在一定条件下,某密闭容器中发生反应:2SO2(g)+O2(g)A.1.4 mol B.1.6 mol C.1.8 mol D.2.0 mol
A 可设原平衡时SO2、O2、SO3的物质的量分别为3x、2x、4x。升温时,平衡左移,再设SO3的变化量为2y,则SO2的变化量为2y,O2的变化量为y。由此可得下列方程组:![]() ,解此方程组可得,x=0.4 mol,y=0.1 mol。从而得出SO3的物质的量为4x-2y=1.4 mol。
,解此方程组可得,x=0.4 mol,y=0.1 mol。从而得出SO3的物质的量为4x-2y=1.4 mol。

练习册系列答案
相关题目
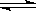 2SO3(g) , △H=
-98.3kJ/mol,反应达到平衡后SO2、O2、SO3的物质的量之比为3:2:5,保持其它条件不变,升温后重新达到平衡,SO3、O2的物质的量分别为2α mol和α mol,则此时容器内SO2的物质的量应为( )。
2SO3(g) , △H=
-98.3kJ/mol,反应达到平衡后SO2、O2、SO3的物质的量之比为3:2:5,保持其它条件不变,升温后重新达到平衡,SO3、O2的物质的量分别为2α mol和α mol,则此时容器内SO2的物质的量应为( )。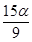 mol B.
mol B. mol C.
mol C.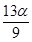 mol D.
mol D.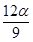 mol
mol 2SO3(g) △H =-a kJ·mol-1。在相同条件下,要想得到2a kJ的热量,加入各物质的物质的量可能是( )
2SO3(g) △H =-a kJ·mol-1。在相同条件下,要想得到2a kJ的热量,加入各物质的物质的量可能是( )