题目内容
在一定条件下,某密闭容器发生如下反应:2SO2(g)+O2(g) 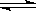 2SO3(g) , △H=
-98.3kJ/mol,反应达到平衡后SO2、O2、SO3的物质的量之比为3:2:5,保持其它条件不变,升温后重新达到平衡,SO3、O2的物质的量分别为2α mol和α mol,则此时容器内SO2的物质的量应为( )。
2SO3(g) , △H=
-98.3kJ/mol,反应达到平衡后SO2、O2、SO3的物质的量之比为3:2:5,保持其它条件不变,升温后重新达到平衡,SO3、O2的物质的量分别为2α mol和α mol,则此时容器内SO2的物质的量应为( )。
A.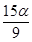 mol B.
mol B. mol C.
mol C.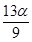 mol D.
mol D.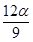 mol
mol
【答案】
B
【解析】
试题分析:设反应达到平衡后SO2、O2、SO3的物质的量分别是3xmol、2xmol、5xmol。升高温度破坏向逆反应方向移动,则生成氧气的物质的量是α
mol-2xmol,所以根据方程式可知,生成的SO2的物质的量是2α mol-4xmol,则平衡后SO2的物质的量是2α mol-4xmol+3xmol。又因为5xmol-2α mol=2α mol-4xmol,解得x= ,所以SO2的物质的量是2α mol-xmo=
,所以SO2的物质的量是2α mol-xmo= mol,答案选B。
mol,答案选B。
考点:考查SO2转化为三氧化硫的有关计算
点评:该题是基础性试题的考查,难度不大。试题设计新颖,难易适中。该题有利于培养学生的逻辑推理能力,以及分析问题、解决问题的能力。

练习册系列答案
相关题目
 2SO3(g) △H =-a kJ·mol-1。在相同条件下,要想得到2a kJ的热量,加入各物质的物质的量可能是( )
2SO3(g) △H =-a kJ·mol-1。在相同条件下,要想得到2a kJ的热量,加入各物质的物质的量可能是( )