题目内容
17.(1)铁钉在氯气中被锈蚀为红棕色物质FeCl3,而在盐酸中生成浅绿色的FeCl2溶液.则在Cl2、Cl-、H+中,具有氧化性的是Cl2、H+,其中氧化性最强的是Cl2.(2)盐酸在不同的反应中,可以分别表现出酸性、氧化性和还原性.现有如下三个反应,请写出盐酸在三个反应中,分别起何种作用:
①Zn+2HCl═ZnCl2+H2↑氧化性、酸性;
②NaOH+HCl═NaCl+H2O酸性;
③2HCl$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑氧化剂、还原剂.
(3)找出(2)中氧化还原反应方程式,并用“双线桥法”标出电子转移的方向和数目.
分析 (1)根据元素的化合价和物质的性质分析;
(2)①Zn+2HCl=ZnCl2+H2↑中,HCl中H元素的化合价降低;
②NaOH+HCl=NaCl+H2O中,没有元素的化合价变化,为中和反应;
③2HCl$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑中,H元素的化合价降低,Cl元素的化合价升高;
(3)利用双线桥表示电子转移,由反应物指向生成物,表示同种元素之间电子得失情况,并注明电子转移数目.
解答 解:(1)在Cl2、Cl-、H+中氢元素处于最高价具有氧化性,氯气容易得电子具有较强的氧化性,所以具有氧化性的是Cl2、H+,其中氧化性最强的是Cl2,
故答案为:Cl2、H+;Cl2;
(2)①Zn+2HCl=ZnCl2+H2↑中,HCl中H元素的化合价降低,则体现其氧化性,反应中生成盐,还表现酸性,故答案为:氧化性、酸性;
②NaOH+HCl=NaCl+H2O中,没有元素的化合价变化,为中和反应,反应生成盐,表现酸性;故答案为:酸性;
③2HCl$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑中,H元素的化合价降低,Cl元素的化合价升高,所以HCl表现了氧化剂、还原剂,故答案为:氧化剂、还原剂;
(3)用双线侨法表示Zn+2HCl═ZnCl2+H2↑反应中电子转移的方向和数目为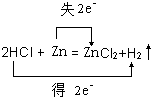 ;
;
用双线侨法表示2HCl$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑反应中电子转移的方向和数目为 ,故答案为:
,故答案为: ,
, .
.
点评 本题考查氧化还原反应的综合应用,题目难度中等,注意从化合价的角度分析,计算时注意氧化还原反应中氧化剂和还原剂之间得失电子数目相等,表现为化合价升降总数相等.

练习册系列答案
相关题目
15.某原电池装置如右图所示,电池总反应为2Ag+Cl2=2AgCl.下列说法正确的是( )


| A. | 正极反应为AgCl+e-═Ag+Cl- | |
| B. | 当电路中转移0.01mole-时,交换膜左侧溶液中约减少0.02mol离子 | |
| C. | 若用NaCl溶液代替盐酸,则电池总反应随之改变 | |
| D. | 放电时,交换膜右侧中有大量白色沉淀生成 |
8.25℃时,5种银盐的溶度积常数(Ksp)分别是:
下列说法正确的是( )
| AgCl | Ag2SO4 | Ag2S | AgBr | AgI |
| 1.8×10-10 | 1.4×10-5 | 6.3×10-50 | 7.7×10-13 | 8.51×10-16 |
| A. | 氯化银、溴化银和碘化银的溶解度依次增大 | |
| B. | 将硫酸银溶解于水后,向其中加入少量硫化钠溶液,不能得到黑色沉淀 | |
| C. | 在5mL1.8×10-5 mol/L的NaCl溶液中,加入1滴(1mL约20滴)0.1 mol/L的AgNO3溶液,不能观察到白色沉淀 | |
| D. | 将浅黄色溴化银固体浸泡在饱和氯化钠溶液中,可以有少量白色固体生成 |
5.室温下,甲、乙两烧杯盛有5mLpH=3的某一元酸溶液,向乙烧杯中加水稀释至pH=4.关于甲、乙烧杯中的描述不正确的是( )
| A. | 溶液的体积:10V甲≤V乙 | |
| B. | 水电离出的OH-浓度:10c(OH-)甲=c(OH-)乙 | |
| C. | 若分别用等浓度的NaOH溶液完全中和,所得溶液的pH:甲≤乙 | |
| D. | 若分别与5mLpH=11的NaOH溶液反应,所得溶液可能显酸性 |
12.有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请回答问题.
(1)已知BA4E为离子化合物,是由NH4+、Cl-两种微粒构成的(填化学符号);
(2)B基态原子中能量最高的电子,其电子云在空间有3个方向,原子轨道呈纺锤形;
(3)某同学根据上述信息,推断C基态原子的核外电子排布为, ,该同学所画的电子排布图违背了泡利原理;
,该同学所画的电子排布图违背了泡利原理;
(4)D是P,E是Cl(填元素符号);
(5)G位于第Ⅷ族,G3+电子排布式为ls22s22p63s23p63d5;
(6)第二、三、四周期中与F同一族的所有元素分别与E元素形成化合物,其晶体的熔点由高到低的排列顺序为(写化学式)LiCl>NaCl>KCl,原因是LiCl、NaCl、KCl均为离子晶体,因为Li+、Na+、K+的半径依次增大,LiCl、NaCl、KCl的晶格能依次减小,故熔点依次降低.
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第八列 |
(2)B基态原子中能量最高的电子,其电子云在空间有3个方向,原子轨道呈纺锤形;
(3)某同学根据上述信息,推断C基态原子的核外电子排布为,
 ,该同学所画的电子排布图违背了泡利原理;
,该同学所画的电子排布图违背了泡利原理;(4)D是P,E是Cl(填元素符号);
(5)G位于第Ⅷ族,G3+电子排布式为ls22s22p63s23p63d5;
(6)第二、三、四周期中与F同一族的所有元素分别与E元素形成化合物,其晶体的熔点由高到低的排列顺序为(写化学式)LiCl>NaCl>KCl,原因是LiCl、NaCl、KCl均为离子晶体,因为Li+、Na+、K+的半径依次增大,LiCl、NaCl、KCl的晶格能依次减小,故熔点依次降低.
9.原子序数逐渐增大的元素A、B、C、D、E、F的有关信息如下:
根据以上表格信息回答:
(1)元素F在周期表中的位置是第四周期IB族,E形成的低价离子的电子排布式为1s22s22p63s23p63d10.
(2)A、C的氢化物沸点较高的是(用所形成的氢化物表示)H2O,A、B、C的第一电离能大小顺序是(用元素符号表示)N>O>C.
(3)A与氢元素形成的A2H2含有的σ键、π键数目之比为3:2.
(4)KCl的晶胞如图:“●K,○Cl”,则该晶胞中含K+为4个,已知晶胞参数为:629.8pm(1pm=10-12m),求KCl晶体的密度为$\frac{4×(39+35.5)}{6.02×1{0}^{23}×(629.8×1{0}^{-10})^{3}}$g/cm3(只写出表达式,不要求计算结果).

(5)用惰性电极电解FCl2溶液时,在阴极除了析出红色固体外,还析出白色固体,经检验白色固体为FCl,请写出析出白色固体的阴极反应式Cu2++Cl-+e-=CuCl.
| 代号 | 信息 |
| A | 原子最外层电子数为内层电子数的2倍 |
| C | 形成的一种单质可抵御紫外线对地球生物的伤害 |
| D | 是一种非金属元素,属于卤族之一,形成的气体常温常压下为黄绿色 |
| E | 单质是生活中使用最广泛的金属 |
| F | 形成的一种化合物可用于醛基的检验 |
(1)元素F在周期表中的位置是第四周期IB族,E形成的低价离子的电子排布式为1s22s22p63s23p63d10.
(2)A、C的氢化物沸点较高的是(用所形成的氢化物表示)H2O,A、B、C的第一电离能大小顺序是(用元素符号表示)N>O>C.
(3)A与氢元素形成的A2H2含有的σ键、π键数目之比为3:2.
(4)KCl的晶胞如图:“●K,○Cl”,则该晶胞中含K+为4个,已知晶胞参数为:629.8pm(1pm=10-12m),求KCl晶体的密度为$\frac{4×(39+35.5)}{6.02×1{0}^{23}×(629.8×1{0}^{-10})^{3}}$g/cm3(只写出表达式,不要求计算结果).

(5)用惰性电极电解FCl2溶液时,在阴极除了析出红色固体外,还析出白色固体,经检验白色固体为FCl,请写出析出白色固体的阴极反应式Cu2++Cl-+e-=CuCl.
6.在实验室中,下列除杂(括号内物质为杂质)的方法正确的是( )
| A. | 溴苯(溴):加入KI溶液,振荡,分液 | |
| B. | 乙烷(乙烯):通过盛有KMnO4溶液的洗气瓶 | |
| C. | 硝基苯(浓HNO3):将其倒入足量NaOH溶液中,振荡、静置,分液 | |
| D. | 乙烯(SO2):通过盛有溴水的洗气瓶 |
7.在2L密闭容器中,发生反应2A+B=2C+D,若最初A、B都是8mol,在前10s 内A 的平均速率为0.24mol/(L?s),则10s时B的物质的量是( )
| A. | 2.4mol | B. | 3.2mol | C. | 4.8mol | D. | 5.6mol |
