题目内容
5.室温下,甲、乙两烧杯盛有5mLpH=3的某一元酸溶液,向乙烧杯中加水稀释至pH=4.关于甲、乙烧杯中的描述不正确的是( )| A. | 溶液的体积:10V甲≤V乙 | |
| B. | 水电离出的OH-浓度:10c(OH-)甲=c(OH-)乙 | |
| C. | 若分别用等浓度的NaOH溶液完全中和,所得溶液的pH:甲≤乙 | |
| D. | 若分别与5mLpH=11的NaOH溶液反应,所得溶液可能显酸性 |
分析 A.如果酸为强酸,则10V甲=V乙,如果酸为弱酸,则10V甲<V乙;
B.两溶液都是酸溶液,酸溶液中的氢氧根离子是水电离的,根据水的离子积计算出水电离的氢氧根离子浓度;
C.如果生成的盐不水解,则两溶液的pH相等,如果生成的盐水解,则甲烧杯中溶液的碱性大于乙烧杯溶液的碱性;
D.如果酸是强酸,则恰好反应,溶液为中性;如果酸是弱酸,则酸过量,反应后的混合液可能显示酸性.
解答 解:A.若酸为强酸,则依据溶液吸稀释过程中氢离子浓度不变5ml×10-3=V×10-4,解得V=5Oml,则10V甲=V乙,若酸为弱酸,加水稀释时,促进弱酸的电离,电离产生的氢离子增多,要使pH仍然为4,加入的水应该多一些,所以10V甲<V乙,所以10V甲≤V乙,故A正确;
B.酸溶液中的氢氧根离子是水电离的,则pH=3的酸中,水电离的氢氧根离子浓度为,c(OH-)甲=$\frac{{K}_{W}}{c({H}^{+})}$=10-11mol/L,pH=4的酸中,水电离的氢氧根离子浓度为,c(OH-)乙=$\frac{{K}_{W}}{c({H}^{+})}$=10-10mol/L,则10c(OH-)甲=c(OH-)乙,故B正确;
C.稀释前后甲乙两个烧杯中所含的一元酸的物质的量相等,依据酸碱中和反应可知,消耗氢氧化钠的物质的量相等,生成的酸盐的浓度甲>乙,若酸为强酸,则二者的pH相等,若酸为弱酸,则甲溶液的pH大于乙,即:甲≥乙,故C错误;
D.若酸是强酸,分别与5mL pH=11的NaOH溶液反应,恰好发生酸碱中和,生成强酸强碱盐,溶液显中性,若为弱酸,则反应后酸有剩余,溶液可能显酸性,故D正确;
故选C.
点评 本题考查了弱电解质的电离、酸碱混合的定性判断及pH的相关计算,题目难度中等,注意掌握溶液酸碱性与溶液pH的关系,正确理解题意,明确弱酸存在电离平衡的特点为解答本题的关键.

| A. | 加入少量NH4Cl固体,平衡逆移溶液中c(NH4+)减小 | |
| B. | 加入少量浓盐酸,浓盐酸与 NH3•H2O反应,电离平衡逆移 | |
| C. | 加热,电离平衡逆移 | |
| D. | 加水后,溶液中n(OH-)增大 |
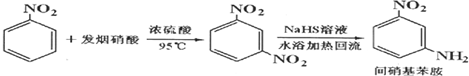
(发烟硝酸是溶有NO2的98%的浓硝酸)
①在圆底烧瓶中加入原料,加热搅拌使充分反应;
②将反应物倒入盛有碎冰的烧杯,待冷却结晶后倾倒出酸液,对剩余混合物进行抽滤;
③将滤出固体溶于甲醇,置于烧瓶中按照图1装置安装,并加入NaHS溶液,加热;
| 参考数据 | 组分 | 邻硝基苯胺 | 间硝基苯胺 | 对硝基苯胺 | 水 | 甲醇 | 硝基苯 |
| 沸点/℃ | 284 | 305.7 | 331.7 | 100 | 64.7 | 4.75 | |
| 偶极矩/D | 4.38 | 4.91 | 6.33 | 1.85 | 1.69 | 4.75 | |
| 颜色 | 橙色 | 淡黄色 | 淡黄色 | 无色 | 无色 | 淡黄色 |
已知:偶极矩可表示分子受固定相吸附的能力,越大吸附力越强请回答下列问题:

(1)步骤①中反应前期加热温度如超过95℃,易造成原料损失,故加热方式应为水浴加热;
(2)步骤②中抽滤的同时需用饱和Na2CO3溶液对固体进行洗涤,目的是洗去产物中混有的酸性物质,简述洗涤的操作过程在布氏漏斗中倒入饱和Na2CO3溶液至浸没固体后抽滤,重复若干次;
(3)步骤③装置(图1)中a仪器名称为干燥管,其中填充有碱石灰,作用是吸收挥发出的硝酸、NO2等酸性物质;
(4)关于步骤④装置(图2)相关叙述错误的是BCD;
A.冷凝水流向错误,应为低流进高流出
B.锥形瓶中首先收集到的液体为蒸馏水
C.温度计水银球位置偏低,应在液面以上,紧贴液面以迅速测定气体组分的温度
D.图1、2装置中b、c均有冷凝效果,故步骤④可在图1装置中直接完成蒸馏,无需改为图2装置
(5)最终得到的产品中含有少量邻硝基苯胺、对硝基苯胺以及硝基苯杂质,根据固定相对各组分在流动过程中的吸附能力大小可混合物分离.图3所示为混合物,已知C为间硝基苯胺,写出B的结构简式
 ;
;(6)之后该同学设计的提纯装置如图4:在一根底部带有旋塞的玻璃管内装满固定相,将流动相与样品混合后从上端倒入,并持续倒入流动相,一段时间后发现管内出现如图四段黄色色带,则本实验所需收集的产物组分主要集中在色带层② (填编号)上.
| A. | 纯水 | B. | 稀硫酸 | C. | 氯化钡溶液 | D. | 硫酸钠溶液 |
2min后,反应达到平衡,生成C为1.6mol.则下列分析正确的是( )
| A. | 若反应开始时容器体积为2 L,则v(C)=0.4mol•L-1•min-1 | |
| B. | 若该反应在恒温恒容下进行,放出热量将增加 | |
| C. | 若2 min后,向容器中再投入等物质的量A、C,则B的转化率不变 | |
| D. | 若在恒压绝热条件下反应,平衡后n(C)<1.6mol |
| A. | BaCl2溶液与稀硫酸反应 | B. | Ba(OH)2溶液与Na2SO4溶液反应 | ||
| C. | Ba(OH)2溶液与NaHSO4溶液反应 | D. | Ba(NO3)2溶液与MgSO4溶液反应 |
| A. | 正、逆反应速率相等且都为零 | B. | 化学反应停止 | ||
| C. | 反应物和生成物共存 | D. | 反应物和生成物浓度均不再变化 |
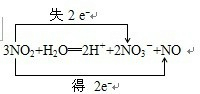 .
.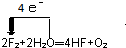 .
.