题目内容
2.A、B、C、D、E为短周期主族元素,原子序数依次增大,A为半径最小的元素,B的一种核素常用于文物鉴定,化合物BC与N2互为等电子体,D的氢化物有臭鸡蛋气味,F位于第四周期IB族.(1)E-的原子结构示意图

(2)实验室制取B2A2的化学反应方程式CaC2+2H2O=Ca(OH)2+C2H2↑
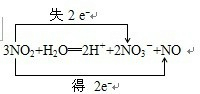
(3)将C2通入FeDO4的离子方程式4Fe2++O2+4H+=4Fe3++2H2O
(4)A2D、A2C的沸点谁高些,为什么?H2O沸点较高,H2S、H2O均属于分子晶体,但H2O分子之间存在氢键
(5)E与C2H6反应生成一取代物,此取代物中的E如何检验?CH3CH2Cl在氢氧化钠水溶液、加热条件下发生水解反应,然后加入硝酸酸化,再滴加硝酸银溶液,有白色沉淀产生
(6)F的晶胞密度为a g/cm3 边长b pm 则NA为$\frac{4×64}{a×(b×1{0}^{-10})^{3}}$.
分析 A、B、C、D、E为短周期主族元素,原子序数依次增大,A为半径最小的元素,则A为H元素;B的一种核素常用于文物鉴定,则B为碳元素;化合物BC与N2互为等电子体,则C为O元素;D的氢化物有臭鸡蛋气味,则D为S元素,可推知E为Cl;F位于第四周期IB族,则F为Cu,据此解答.
解答 解:A、B、C、D、E为短周期主族元素,原子序数依次增大,A为半径最小的元素,则A为H元素;B的一种核素常用于文物鉴定,则B为碳元素;化合物BC与N2互为等电子体,则C为O元素;D的氢化物有臭鸡蛋气味,则D为S元素,可推知E为Cl;F位于第四周期IB族,则F为Cu.
(1)Cl-的原子结构示意图为 ,故答案为:
,故答案为: ;
;
(2)实验室制取C2H2的化学反应方程式:CaC2+2H2O=Ca(OH)2+C2H2↑,故答案为:CaC2+2H2O=Ca(OH)2+C2H2↑;
(3)将O2通入FeSO4的离子方程式:4Fe2++O2+4H+=4Fe3++2H2O,故答案为:4Fe2++O2+4H+=4Fe3++2H2O;
(4)H2S、H2O均属于分子晶体,但H2O分子之间存在氢键,其沸点高于H2S的,
故答案为:H2O的沸点较高;H2S、H2O均属于分子晶体,但H2O分子之间存在氢键;
(5)氯气与C2H6反应生成一取代物CH3CH2Cl,检验取代物中的Cl元素:CH3CH2Cl在氢氧化钠水溶液、加热条件下发生水解反应,然后加入硝酸酸化,再滴加硝酸银溶液,有白色沉淀产生,
故答案为:CH3CH2Cl在氢氧化钠水溶液、加热条件下发生水解反应,然后加入硝酸酸化,再滴加硝酸银溶液,有白色沉淀产生;
(6)Cu晶胞为面心立方最密堆积,晶胞中Cu原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,则晶胞质量为$\frac{4×64}{{N}_{A}}$g,晶胞密度为a g/cm3、边长b pm,则(b×10-10 cm)3×a g/cm3=$\frac{4×64}{{N}_{A}}$g,故NA=$\frac{4×64}{a×(b×1{0}^{-10})^{3}}$,
故答案为:$\frac{4×64}{a×(b×1{0}^{-10})^{3}}$.
点评 本题考查结构性质位置关系应用,需要学生具备扎实的基础,(6)中注意识记常见金属晶体的堆积方式.

| A. | 组成元素相同,分子结构不同 | |
| B. | 组成元素的质量分数相同,只有化学性质不同 | |
| C. | 具有相同分子量而结构不同 | |
| D. | 具有相同分子量,且组成元素及组成元素的质量分数相同,只是结构不同 |
| A. | 纯水 | B. | 稀硫酸 | C. | 氯化钡溶液 | D. | 硫酸钠溶液 |
| A. | BaCl2溶液与稀硫酸反应 | B. | Ba(OH)2溶液与Na2SO4溶液反应 | ||
| C. | Ba(OH)2溶液与NaHSO4溶液反应 | D. | Ba(NO3)2溶液与MgSO4溶液反应 |
| 部分结构知识 | 部分性质 | |
| X | X的单质由双原子分子构成,分子中有14个电子 | X有多种氧化物,如XO、XO2、X2O4等;通常情况下XO2与X2O4共存 |
| Y | Y原子的次外层电子数等于最外层电子数的一半 | Y能形成多种气态氢化物 |
| Z | Z原子的最外层电子数多于4 | Z元素的最高正化合价与最低负化合价代数和等于6 |
| W | W原子的最外层电子数等于2n-3 (n为原子核外电子层数) | 化学反应中W原子易失去最外层电子形成Wn+ |
(1)X的气态氢化物分子的价层电子对互斥模型是四面体、其分子构型是三角锥形.Z元素在周期表中的位置是第三周期第VIIA族.
(2)X的第一电离能比它同周期后一主族的元素的第一电离能大的原因是N元素原子2p能级容纳3个电子,为半满稳定状态,能量较低.
(3)Y与氢形成的最简单的氢化物的键角是109°28′.
(4)实验室用X的氢化物的水溶液制取W的氢氧化物的方法是(用离子方程式表示)Al3++3NH3•H2O═Al(OH)3↓+3NH4+.
(5)z的不同价态的含氧酸的酸性的酸性从大到小的顺序是HClO4>HClO3>HClO其原因是中心原子的正电性越高越容易电离出氢离子用中心原子的正电性解释)
 .
.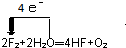 .
.
 .
.