题目内容
有 ①Na2CO3溶液 ②CH3COONa溶液 ③NaOH溶液各25mL,物质的量浓度相等,下列说法正确的是( )
| A、3种溶液pH的大小顺序是 ③>②>① |
| B、若分别滴加25mL和上述溶液等浓度的盐酸后,pH最大的是① |
| C、若将3种溶液稀释相同倍数,pH变化最大的是② |
| D、若3种溶液的pH均为9,则物质的量浓度的大小顺序是③>①>② |
考点:盐类水解的应用
专题:盐类的水解专题
分析:A.等浓度时强碱的pH最大,强碱弱酸盐中对应的酸性越强,水解程度越小;
B.根据酸碱混合后溶液中的溶质来分析;
C.稀释时强碱的变化程度大;
D.三种溶液的pH均为9,c(OH-)=10-5mol/L,c(NaOH)=10-5mol/L,但碳酸的酸性小于醋酸的酸性,所以c(Na2CO3)>c(CH3COONa)>10-5mol/L.
B.根据酸碱混合后溶液中的溶质来分析;
C.稀释时强碱的变化程度大;
D.三种溶液的pH均为9,c(OH-)=10-5mol/L,c(NaOH)=10-5mol/L,但碳酸的酸性小于醋酸的酸性,所以c(Na2CO3)>c(CH3COONa)>10-5mol/L.
解答:
解:A.等浓度时强碱的pH最大,强碱弱酸盐中对应的酸性越强,水解程度越小,碳酸的酸性小于醋酸的,所以三种溶液pH的大小顺序是③>①>②,故A错误;
B.等体积等浓度混合后,①中溶质为NaHCO3、NaCl,②中溶质为NaCl、CH3COOH,③中溶质为NaCl,HCO3-离子水解显碱性,所以pH最大的是①,故B正确;
C.稀释时强碱的变化程度大,所以三种溶液稀释相同倍数,pH变化最大的是③,故C错误;
D.三种溶液的pH均为9,c(OH-)=10-5mol/L,c(NaOH)=10-5mol/L,但碳酸的酸性小于醋酸的酸性,所以c(CH3COONa)>c(Na2CO3)>10-5mol/L,所以三种溶液的pH均为9,则物质的量浓度的大小顺序是②>①>③,故D错误;
故选B.
B.等体积等浓度混合后,①中溶质为NaHCO3、NaCl,②中溶质为NaCl、CH3COOH,③中溶质为NaCl,HCO3-离子水解显碱性,所以pH最大的是①,故B正确;
C.稀释时强碱的变化程度大,所以三种溶液稀释相同倍数,pH变化最大的是③,故C错误;
D.三种溶液的pH均为9,c(OH-)=10-5mol/L,c(NaOH)=10-5mol/L,但碳酸的酸性小于醋酸的酸性,所以c(CH3COONa)>c(Na2CO3)>10-5mol/L,所以三种溶液的pH均为9,则物质的量浓度的大小顺序是②>①>③,故D错误;
故选B.
点评:本题考查盐类水解、pH的计算等,明确酸碱混合的计算,盐类水解的规律、pH与浓度的关系等知识即可解答,题目难度不大.

练习册系列答案
 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案
相关题目
可逆反应mA(固)+nB(气)?Pc (气)+qD(气)反应过程中其他条件不变时C的百分含量C%与温度(T)和压强(p)的关系如图所示,下列叙述中正确的是( )
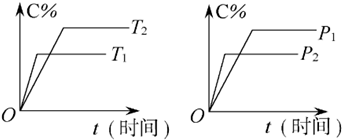

| A、达到平衡后,使用催化剂,C%将增大 |
| B、达到平衡后,若升高温度,化学平衡向逆反应方向移动 |
| C、方程式中n>p+q |
| D、达到平衡后,增加A的量有利于化学平衡向正反应方向移动 |
下列关于平衡常数K的说法中,正确的是( )
| A、在任何条件下,化学平衡常数是一个恒定值 |
| B、从平衡常数K的大小可以推断一个反应进行的程度 |
| C、平衡常数K只与温度有关,与反应起始浓度、压强无关 |
| D、改变反应物浓度或生成物浓度都会改变平衡常数K |
下列关于配合物的叙述中,不正确的是( )
| A、配合物中必定存在配位键 |
| B、配合物中只有配位键 |
| C、[Cu(H2O)6]2+中的Cu2+提供空轨道,H2O中的氧原子提供孤电子对形成配位键 |
| D、配合物在半导体等尖端技术、医学科学、催化反应和材料化学等领域都有着广泛的应用 |
下列说法不正确的是( )
| A、在纯水中加入能水解的盐一定促进水的电离 | ||
| B、NH4F水溶液中含有HF,因此NH4F溶液不能存放于玻璃试剂瓶中 | ||
C、加热CH3COONa溶液,溶液中
| ||
| D、常温下醋酸分子不可能存在于pH>7的碱性溶液中 |
下列反应中水作氧化剂的是( )
| A、2Na+2H2O═2NaOH+H2↑ |
| B、2F2+2H2O═4HF+O2↑ |
| C、SO2+H2O═H2SO3 |
| D、Cl2+H2O═HCl+HClO |
