题目内容
(i)A、B、C、D是四种常见的单质,A、B为金属,C、D常温下是气体,且D为黄绿色气体.
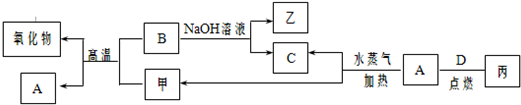
甲、乙、丙为常见的化合物,甲是黑色且具有磁性的物质.它们之间的转化关系如图所示:
请回答下列问题:
(1)B与甲反应的化学方程式是 .
(2)常温下,将A或B的单质放入浓硫酸或浓硝酸中,是否溶解? (填“是”或“否”).
(3)将丙溶于水配成溶液,检验丙中阳离子的方法是 .
(4)写出A与水蒸气反应生成C和甲的化学方程式 .
(5)将A、B两种金属按一定的质量比组成混合物.
①取一定质量的该混合物,向其中加入足量的NaOH溶液,生成气体的体积在标准状况下为n L,B与NaOH溶液反应的离子方程式是 ,混合物中B的物质的量为 mol(用含字母的分数式表示).
②另取相同质量的该混合物,向其中加入足量的稀硫酸,固体全部溶解,生成气体的体积在标准状况下为m L,该反应中转移电子的物质的量为 mol,混合物中A的质量为 g(用含字母的分数式表示).
(ii)
(一)选择除去下列各组物质中的杂质(括号内物质为杂质)的试剂和方法,填于表:
(二)氯乙烯是合成聚氯乙烯的单体.裂解法生产氯乙烯的方法如下图所示:

按要求回答下列问题:
(1)A的分子式为 .
(2)从绿色化学角度考虑,裂解法的优点是 .
(3)1,2-二氯乙烷与氢氧化钠水溶液共热可以生成乙二醇(HOCH2CH2OH),请写出该反应的化学方程式: .
(4)焚烧废旧塑料过程中会排放有毒物质.写出聚氯乙烯塑料完全燃烧的化学方程式: .

甲、乙、丙为常见的化合物,甲是黑色且具有磁性的物质.它们之间的转化关系如图所示:
请回答下列问题:
(1)B与甲反应的化学方程式是
(2)常温下,将A或B的单质放入浓硫酸或浓硝酸中,是否溶解?
(3)将丙溶于水配成溶液,检验丙中阳离子的方法是
(4)写出A与水蒸气反应生成C和甲的化学方程式
(5)将A、B两种金属按一定的质量比组成混合物.
①取一定质量的该混合物,向其中加入足量的NaOH溶液,生成气体的体积在标准状况下为n L,B与NaOH溶液反应的离子方程式是
②另取相同质量的该混合物,向其中加入足量的稀硫酸,固体全部溶解,生成气体的体积在标准状况下为m L,该反应中转移电子的物质的量为
(ii)
(一)选择除去下列各组物质中的杂质(括号内物质为杂质)的试剂和方法,填于表:
| 乙醇(乙酸) | 乙烯(二氧化硫) | 乙酸乙酯(乙醇) | |
| 加入试剂 | |||
| 分离方法 |

按要求回答下列问题:
(1)A的分子式为
(2)从绿色化学角度考虑,裂解法的优点是
(3)1,2-二氯乙烷与氢氧化钠水溶液共热可以生成乙二醇(HOCH2CH2OH),请写出该反应的化学方程式:
(4)焚烧废旧塑料过程中会排放有毒物质.写出聚氯乙烯塑料完全燃烧的化学方程式:
考点:无机物的推断,有机物的合成
专题:推断题,有机物的化学性质及推断
分析:(i)A、B、C、D是四种常见的单质,A、B为金属,C、D常温下是气体,且D为黄绿色气体,D为Cl2,甲是黑色且具有磁性的物质,则甲为Fe3O4,甲与B的反应为铝热反应,B为Al,A为Fe,乙为NaAlO2,C为H2,Fe与氯气反应生成丙,丙为FeCl3,然后结合元素化合物性质及离子检验来解答;
(ii)(一)乙酸与NaOH反应,而乙醇不能,然后利用沸点不同分离;二氧化硫与NaOH反应,而乙烯不能;乙醇易溶于饱和碳酸钠溶液中,与乙酸乙酯分层;
(二)由合成流程可知,①为乙烯的加成反应,②为热裂解,由原子守恒可知,生成的A为HCl,HCl为反应③的反应物,可循环使用,减少有害气体的排放,结合有机物的性质及化学用语来解答.
(ii)(一)乙酸与NaOH反应,而乙醇不能,然后利用沸点不同分离;二氧化硫与NaOH反应,而乙烯不能;乙醇易溶于饱和碳酸钠溶液中,与乙酸乙酯分层;
(二)由合成流程可知,①为乙烯的加成反应,②为热裂解,由原子守恒可知,生成的A为HCl,HCl为反应③的反应物,可循环使用,减少有害气体的排放,结合有机物的性质及化学用语来解答.
解答:
解:(i)A、B、C、D是四种常见的单质,A、B为金属,C、D常温下是气体,且D为黄绿色气体,D为Cl2,甲是黑色且具有磁性的物质,则甲为Fe3O4,甲与B的反应为铝热反应,B为Al,A为Fe,乙为NaAlO2,C为H2,Fe与氯气反应生成丙,丙为FeCl3,
(1)B与甲反应的化学方程式是3Fe3O4+8Al
9Fe+4Al2O3,故答案为:3Fe3O4+8Al
9Fe+4Al2O3;
(2)常温下,将A或B的单质放入浓硫酸或浓硝酸中,发生钝化,不能完全溶解,故答案为:否;
(3)丙中含铁离子,则检验方法为取少量丙的溶液于试管中,滴加KSCN溶液,若溶液变红,说明丙中存在Fe3+,
故答案为:取少量丙的溶液于试管中,滴加KSCN溶液,若溶液变红,说明丙中存在Fe3+;
(4)A与水蒸气反应生成C和甲的化学方程式为3Fe+4H2O(g)
Fe3O4+4H2,故答案为:3Fe+4H2O(g)
Fe3O4+4H2;
(5)①Al与NaOH溶液反应的离子反应为2Al+2OH-+6H2O=2AlO2-+3H2↑,氢气的物质的量为
mol,由反应可知,Al的物质的量为
×
=
mol,
故答案为:2Al+2OH-+6H2O=2AlO2-+3H2↑;
;
②相同质量的该混合物,向其中加入足量的稀硫酸,2Al~3H2↑,n(Al)=
mol;Fe~H2↑,共转移的电子为
mol×2×(1-0)=
mol,Fe的物质的量为
mol-
mol,其质量为
×56g,故答案为:
;
×56;
(ii)(一)乙酸与NaOH反应,而乙醇不能,然后利用沸点不同分离,则分离方法为蒸馏;二氧化硫与NaOH反应,而乙烯不能,则利用洗气法分离;乙醇易溶于饱和碳酸钠溶液中,与乙酸乙酯分层,然后利用分液分离,
故答案为:
(二)由合成流程可知,①为乙烯的加成反应,②为热裂解,由原子守恒可知,生成的A为HCl,HCl为反应③的反应物,可循环使用,
(1)由上述分析可知,A为HCl,故答案为:HCl;
(2)结合流程及绿色化学角度考虑,裂解法的优点是利用二氯乙烷热裂解所产生的HCl作为氯化剂,从而使氯得到完全利用,不向环境排放有毒、有害气体,
故答案为:利用二氯乙烷热裂解所产生的HCl作为氯化剂,从而使氯得到完全利用,不向环境排放有毒、有害气体;
(3)1,2-二氯乙烷与氢氧化钠水溶液共热可以生成乙二醇(HOCH2CH2OH),为水解反应,该反应为ClCH2-CH2Cl+NaOH
HOCH2-CH2OH+2NaCl,
故答案为:ClCH2-CH2Cl+NaOH
HOCH2-CH2OH+2NaCl;
(4)聚氯乙烯塑料完全燃烧的化学方程式为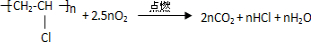 ,
,
故答案为: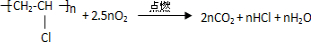 .
.
(1)B与甲反应的化学方程式是3Fe3O4+8Al
| ||
| ||
(2)常温下,将A或B的单质放入浓硫酸或浓硝酸中,发生钝化,不能完全溶解,故答案为:否;
(3)丙中含铁离子,则检验方法为取少量丙的溶液于试管中,滴加KSCN溶液,若溶液变红,说明丙中存在Fe3+,
故答案为:取少量丙的溶液于试管中,滴加KSCN溶液,若溶液变红,说明丙中存在Fe3+;
(4)A与水蒸气反应生成C和甲的化学方程式为3Fe+4H2O(g)
| ||
| ||
(5)①Al与NaOH溶液反应的离子反应为2Al+2OH-+6H2O=2AlO2-+3H2↑,氢气的物质的量为
| n |
| 22.4 |
| n |
| 22.4 |
| 2 |
| 3 |
| n |
| 33.6 |
故答案为:2Al+2OH-+6H2O=2AlO2-+3H2↑;
| n |
| 33.6 |
②相同质量的该混合物,向其中加入足量的稀硫酸,2Al~3H2↑,n(Al)=
| n |
| 33.6 |
| m |
| 22.4 |
| m |
| 11.2 |
| m |
| 22.4 |
| n |
| 22.4 |
| m-n |
| 22.4 |
| m |
| 11.2 |
| m-n |
| 22.4 |
(ii)(一)乙酸与NaOH反应,而乙醇不能,然后利用沸点不同分离,则分离方法为蒸馏;二氧化硫与NaOH反应,而乙烯不能,则利用洗气法分离;乙醇易溶于饱和碳酸钠溶液中,与乙酸乙酯分层,然后利用分液分离,
故答案为:
| NaOH(aq) | NaOH(aq) | 饱和碳酸钠(aq) | |
| 蒸馏 | 洗气 | 分液 |
(1)由上述分析可知,A为HCl,故答案为:HCl;
(2)结合流程及绿色化学角度考虑,裂解法的优点是利用二氯乙烷热裂解所产生的HCl作为氯化剂,从而使氯得到完全利用,不向环境排放有毒、有害气体,
故答案为:利用二氯乙烷热裂解所产生的HCl作为氯化剂,从而使氯得到完全利用,不向环境排放有毒、有害气体;
(3)1,2-二氯乙烷与氢氧化钠水溶液共热可以生成乙二醇(HOCH2CH2OH),为水解反应,该反应为ClCH2-CH2Cl+NaOH
| H2O |
故答案为:ClCH2-CH2Cl+NaOH
| H2O |
(4)聚氯乙烯塑料完全燃烧的化学方程式为
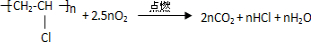 ,
,故答案为:
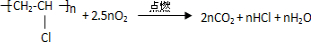 .
.
点评:本题综合考查无机物的推断、有机物的合成及有机物的分离、提纯等,注意利用物质的性质及转化关系推断物质为解答的关键,侧重分析能力、推断能力及知识综合应用能力的考查,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
室温下,在强酸性溶液中能大量共存的离子组是( )
| A、Na+、Ca2+、ClO-、Br- |
| B、K+、Na+、CO32-、HCO3- |
| C、NH4+、Fe3+、Cl-、NO3- |
| D、Ba2+、Cu2+、Cl-、SO42- |
下列化学反应的离子方程式正确的是( )
| A、将少量金属钠放入冷水中:Na+2H2O=Na++2OH-+H2↑ |
| B、将氢氧化铝加入烧碱溶液中:Al(OH)3+OH-=AlO2-+2H2O |
| C、碳酸钙溶于稀盐酸:CO32-+2H+═H2O+CO2↑ |
| D、硫酸亚铁溶液中加入酸化的双氧水:Fe2++2H++H2O2=Fe3++2H2O |
下列溶液中各微粒的浓度关系不正确的是( )
| A、0.1mol/L的 NaHCO3溶液中:c (Na+)+c (H+)+C(H2CO3)=c (HCO3-)+c(CO32-)+c (OH-) |
| B、等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中:C(Na+)>C(HX)>C(X-)>C(H+)>C(OH-) |
| C、在纯碱溶液中存在:C(OH-)=C(H+)+C(HCO3-)+2C(H2CO3) |
| D、0.1mol/L HCOOH溶液中:C(HCOO-)+C(OH-)=C(H+) |
 .请写出有机化合物A与稀、冷的KMnO4溶液在碱性条件下反应的化学方程式:
.请写出有机化合物A与稀、冷的KMnO4溶液在碱性条件下反应的化学方程式:

