题目内容
在一定条件下,下列粒子的还原性顺序为:Cl-<Br-<Fe2+<I-<SO2,由此判断以下各反应在溶液中不能发生的是( )
| A、2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ |
| B、I2+SO2+2H2O=4H++SO42-+2I- |
| C、2Fe2++Cl2=2Fe3++2Cl- |
| D、2Br-+4H++SO42-=SO2+Br2+2H2O |
考点:氧化性、还原性强弱的比较
专题:氧化还原反应专题
分析:根据氧化还原反应中,还原剂的还原性强于还原产物的还原性规律来分析,反应中还原性符合,还原性顺序为:Cl-<Br-<Fe2+<I-<SO2,即可发生.
解答:
解:A、根据反应得出还原性强弱是:SO2>Fe2+,和题干的还原性强弱吻合,所以A能发生,故A不选;
B、根据反应得出还原性强弱是:SO2>I-,和题干的还原性强弱吻合,所以B能发生,故B不选;
C、根据反应得出还原性强弱是:Fe2+>Cl-,和题干的还原性强弱吻合,所以C能发生,故C不选;
D、根据反应得出还原性强弱是:SO2<Br-,和题干的还原性强不弱吻合,所以D不能发生,故D选.
故选D.
B、根据反应得出还原性强弱是:SO2>I-,和题干的还原性强弱吻合,所以B能发生,故B不选;
C、根据反应得出还原性强弱是:Fe2+>Cl-,和题干的还原性强弱吻合,所以C能发生,故C不选;
D、根据反应得出还原性强弱是:SO2<Br-,和题干的还原性强不弱吻合,所以D不能发生,故D选.
故选D.
点评:本题考查学生氧化还原反应的基本概念和氧化性还原性强弱的判断规律,可以根据所学知识进行回答,难度不大.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
700℃时,H2(g)+CO2(g)?H2O(g)+CO(g).该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2和CO2,起始浓度如下表所示.其中甲经2min达平衡时,v(H2O)为0.025mol/(L?min),下列判断不正确的是( )
| 起始浓度 | 甲 | 乙 | 丙 |
| c(H2)/mol/L | 0.10 | 0.20 | 0.20 |
| c(CO2)/mol/L | 0.10 | 0.10 | 0.20 |
| A、平衡时,乙中CO2的转化率大于50% | ||
| B、当反应平衡时,丙中c(CO2)是甲中的2倍 | ||
C、温度升至800℃,上述反应平衡常数为
| ||
| D、其他条件不变,若起始时向容器乙中充入0.10mol/L H2和0.20 mol/L CO2,到达平衡时c (CO)与乙不同 |
250℃和1.01×105Pa时,反应 2N2O5(g)=4NO2(g)+O2(g);△H=+56.76kJ?mol-1,自发进行的原因是( )
| A、是吸热反应 |
| B、是放热反应 |
| C、是熵减少的反应 |
| D、熵增大效应大于焓变效应 |
如图是X、Y两种固体物质的溶解度曲线,下列说法不正确的是( )
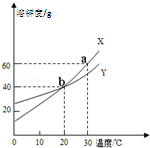

| A、将20℃的饱和溶液X降温到10℃,溶液X仍然是饱和溶液 |
| B、a点表示30℃时,X的溶解度为60g |
| C、b点表示20℃时,X、Y的溶解度相等 |
| D、同质量的X、Y饱和溶液分别从30℃降到10℃时,析出的Y的质量大于X的质量 |
设NA表示阿伏加德罗常数,下列叙述中不正确的是( )
| A、31g仅含有少量白磷,无其他杂质的红磷样品中,共含有NA个磷原子 |
| B、假设1mol氯化铁完全转化为氢氧化铁胶体,则分散系中胶体微粒数小于NA |
| C、1molNa2O2与水反应转移的电子数为NA |
| D、58.5g的氯化钠固体中含有NA个氯化钠分子 |
已知A(g)+B(g)═C(g)△H1,D(g)+B(g)═E(g)△H2.若A和D混合气体1mol与B完全反应,反应热为△H3,则A和D物质的量之比为( )
A、
| ||
B、
| ||
C、
| ||
D、
|
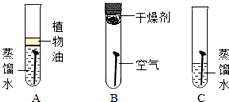 结合下列有关铁的实验,回答有关问题.
结合下列有关铁的实验,回答有关问题.