题目内容
13.能正确表示下列反应的离子方程式的是( )| A. | 将铁粉加入稀硫酸中:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 将磁性氧化铁溶于盐酸:Fe3O4+8H+═3Fe3++4H2O | |
| C. | 将氯化亚铁溶液和氯气反应:Fe2++Cl2═Fe3++2 Cl- | |
| D. | 将铜屑加入含Fe3+的溶液中:2Fe3++Cu═2Fe2++Cu2+ |
分析 A.铁与稀硫酸反应生成硫酸亚铁和氢气;
B.四氧化三铁与盐酸反应生成氯化铁和氯化亚铁;
C.离子方程式两边不满足电荷守恒;
D.铜屑加入含Fe3+的溶液,反应生成亚铁离子和铜离子.
解答 解:A.将铁粉加入稀硫酸中,生成的是亚铁离子,正确的离子方程式为:Fe+2H+═Fe2++H2↑,故A错误;
B.将磁性氧化铁溶于盐酸,反应生成氯化铁和氯化亚铁,正确的离子方程式为:Fe3O4+8H+═2Fe3++Fe2++4H2O,故B错误;
C.将氯化亚铁溶液和氯气反应生成氯化铁,正确的离子方程式为:2Fe2++Cl2═2Fe3++2Cl-,故C错误;
D.铜屑加入含Fe3+的溶液,反应的离子方程式为:2Fe3++Cu═2Fe2++Cu2+,故D正确;
故选D.
点评 本题考查了离子方程式的书写判断,为高考的高频题,题目难度中等,注意掌握离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.物质的体积一定是22.4L的是( )
| A. | 1 mol水蒸汽 | B. | 标准状况下1 mol CCl4 | ||
| C. | 标准状况下44 g二氧化碳 | D. | 0℃、202 kPa时2 g氢气 |
1.X、Y、Z、R是短周期主族元素,X原子最外层电子数是次外层的两倍,Y元素在地壳中的含量最多,Z元素的金属性最强,R原子的核外电子数是X原子与Z原子的核外电子数之和.下列叙述不正确的是( )
| A. | X与Y能形成两种常见的气态化合物 | |
| B. | 原子半径的大小顺序:r(Z)>r(R)>r(X)>r(Y) | |
| C. | X、Z分别与R形成的化合物中化学键类型不同 | |
| D. | 含有Y、Z、R三种元素的化合物最多只有2种 |
8.下列反应中,与其它三个反应不属于同一类型的反应是( )
| A. | 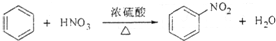 | |
| B. |  | |
| C. | CH3CH2OH+CH3COOH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O | |
| D. | CH4+Cl2$\stackrel{光照}{?}$CH3Cl+HCl |
18.设NA是阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 1L 1mol•L-1NaHCO3溶液中含有HCO3-数目为NA | |
| B. | 1mol Cl2与足量的铁反应,转移的电子数为3NA | |
| C. | 标准状况下,22.4L乙醇的分子数为NA | |
| D. | 17g H2O2所含共价键的总数为1.5NA |
5.下列微粒的表示方法能确定为氟离子的是( )
| A. | X- | B. | 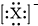 | C. | 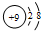 | D. |  |
2.FeS与一定浓度的HNO3反应,生成Fe(NO3)3、Fe2(SO4)3、NO2、NO和H2O,当NO2、N2O4、NO的物质的量之比为4:1:4时,实际参加反应的FeS与HNO3的物质的量之比为( )
| A. | 1:6 | B. | 2:15 | C. | 2:3 | D. | 16:25 |
3.聚合物锂离子电池以其良好的性能、低发热而广泛应用于手机的移动电源.某品牌聚合物锂离子电池的反应如下:LiCo02+n$?_{放电}^{充电}$Li1-xCo02+LixCn.下列说法正确的是( )
| A. | 放电时,负极发生反应的物质是Li1-xCoO2 | |
| B. | 充电时,阴极发生氧化反应 | |
| C. | 放电时,Li+由负极向正极迁移 | |
| D. | 充电时,阳极的电极反应式为:xLi++nC+xe-=LixCn |
 现将一定量的铜片加入到100mL稀硫酸和硫酸铁的混合溶液中,铜片完全溶解(不考虑盐的水解及溶液体积的变化).
现将一定量的铜片加入到100mL稀硫酸和硫酸铁的混合溶液中,铜片完全溶解(不考虑盐的水解及溶液体积的变化).