题目内容
以下液体均处于25℃,有关叙述正确的是( )
| A、某物质的溶液pH<7,则该物质一定是酸或强酸弱碱盐 |
| B、AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同 |
| C、pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍 |
| D、pH=5.6的CH3COOH与CH3COONa混合溶液中,c(Na+)>c(CH3COO-) |
考点:难溶电解质的溶解平衡及沉淀转化的本质,pH的简单计算,离子浓度大小的比较
专题:
分析:A、溶液PH小于7的溶液有酸、强酸弱碱盐以及强酸的酸式盐等;
B、根据AgCl的溶解平衡可知溶液中的Cl-浓度越大,AgCl的溶解度越小;
C、根据PH大小可计算出溶液中H+浓度,pH=4.5,c(H+)=10-4.5 mol?L-1,pH=6.5,其c(H+)=10-6.5mol?L-1;
D、pH=5.6的CH3COOH与CH3COONa混合溶液呈酸性,溶液中H+大于OH-浓度,根据溶液呈电中性,则有c(CH3COO-)>c(Na+).
B、根据AgCl的溶解平衡可知溶液中的Cl-浓度越大,AgCl的溶解度越小;
C、根据PH大小可计算出溶液中H+浓度,pH=4.5,c(H+)=10-4.5 mol?L-1,pH=6.5,其c(H+)=10-6.5mol?L-1;
D、pH=5.6的CH3COOH与CH3COONa混合溶液呈酸性,溶液中H+大于OH-浓度,根据溶液呈电中性,则有c(CH3COO-)>c(Na+).
解答:
解:A、某些强酸的酸式盐如NaHSO4溶液的pH<7,故A错误;
B、当溶液中c(Cl-)不同,平衡向左移动的程度是不同的,所以AgCl的溶解度也是不同的,故B错误;
C、pH=4.5,c(H+)=10-4.5 mol?L-1,pH=6.5,其c(H+)=10-6.5 mol?L-1,c(H+)是100倍的关系,故C正确;
D、混合溶液显酸性,则c(H+)>c (OH-),根据电荷守恒,c(CH3COO-)>c(Na+),故D错误.
故选:C.
B、当溶液中c(Cl-)不同,平衡向左移动的程度是不同的,所以AgCl的溶解度也是不同的,故B错误;
C、pH=4.5,c(H+)=10-4.5 mol?L-1,pH=6.5,其c(H+)=10-6.5 mol?L-1,c(H+)是100倍的关系,故C正确;
D、混合溶液显酸性,则c(H+)>c (OH-),根据电荷守恒,c(CH3COO-)>c(Na+),故D错误.
故选:C.
点评:综合考查了电解质溶液中的有关知识,包括盐类的水解、溶液的pH与c(H+)的关系、沉淀溶解平衡的移动和溶液中离子浓度大小的比较.做题时注意盐溶液类型的积累,对溶液浓度不同类型计算方法的整理以及平衡移动的影响条件的理解.

练习册系列答案
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
相关题目
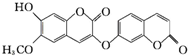 西瑞香素是具有较强的抗肿瘤活性药物,其结构简式如图所示.下列关于西瑞香素的结构和性质叙述正确的是( )
西瑞香素是具有较强的抗肿瘤活性药物,其结构简式如图所示.下列关于西瑞香素的结构和性质叙述正确的是( )| A、分子中所有原子可以处于同一平面 |
| B、该物质能发生加成、氧化、水解、消去等反应 |
| C、能与FeCl3溶液发生显色反应 |
| D、1 mol该有机物最多可与3 mol NaOH反应 |
关于常温下pH=3的醋酸溶液,下列叙述正确的是( )
| A、加水稀释10倍后,pH=4 |
| B、加水稀释后,溶液中c(H+)和c(OH-)均减少 |
| C、加入醋酸钠晶体后,溶液的pH增大 |
| D、加入等体积pH=11的NaOH溶液后,溶液呈中性 |
相同温度下,体积均为0.25L的两个恒容容器中发生可逆反应:X2(g)+3Y2(g)?2XY3(g)△H=-92.6kJ?mol-1,实验测得反应在起始、达到平衡时的有关数据如下表所示:下列叙述不正确的是( )
| 容器编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
| X2 | Y2 | XY3 | ||
| ① | 1 | 3 | 0 | 放热46.3kJ |
| ② | 0.8 | 2.4 | 0.4 | 放热Q kJ |
| A、容器①、②中反应达平衡时XY3的平衡浓度相同 |
| B、容器①、②中达到平衡时各物质的百分含量相同 |
| C、达平衡时,两个容器中XY3的物质的量浓度均为2 mol?L-1 |
| D、若容器①体积为0.20 L,则达平衡时放出的热量大于46.3 kJ |
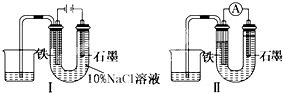 用如图Ⅰ所示装置通电10分钟后,去掉直流电源,连接成图Ⅱ所示装置,可观察到U形管左端铁电极表面析出白色胶状物质,U形管右端液面上升.下列说法正确的是( )
用如图Ⅰ所示装置通电10分钟后,去掉直流电源,连接成图Ⅱ所示装置,可观察到U形管左端铁电极表面析出白色胶状物质,U形管右端液面上升.下列说法正确的是( )| A、用装置Ⅱ进行实验时铁电极的电极反应为Fe-2e-+2OH-=Fe(OH)2 |
| B、装置Ⅰ通电10分钟后铁电极周围溶液pH降低 |
| C、用装置Ⅱ进行实验时石墨电极的电极反应为2H++2e-=H2↑ |
| D、同温、同压下,装置Ⅰ中石墨电极上方得到的气体比铁电极上方得到的气体多 |
下列有关氧化还原反应的说法中错误的是( )
| A、得电子数越多的物质氧化性越强 |
| B、化合反应或分解反应有可能是氧化还原反应 |
| C、离子反应也可以是氧化还原反应 |
| D、氧化还原反应的实质是发生电子转移 |
下列说法正确的是( )
| A、CO的摩尔质量为28 |
| B、常温常压下,NA个氢原子与NA 个氮气的质量比为1:14 |
| C、32克O2所含原子数目为2NA |
| D、常温常压下,1molCO分子所占体积是22.4L |
 在一密闭容器中发生反应:2A(g)+B(g)?E(g)
在一密闭容器中发生反应:2A(g)+B(g)?E(g)