题目内容
15.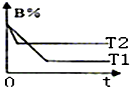 密闭容器中发生反应:A(g)+B(g)?C(g)△H.图中的两条曲线分别表示T1、T2温度下,体系中B的百分含量和时间t的关系.下列判断正确的是( )
密闭容器中发生反应:A(g)+B(g)?C(g)△H.图中的两条曲线分别表示T1、T2温度下,体系中B的百分含量和时间t的关系.下列判断正确的是( )| A. | △H<0,T1<T2 | B. | △H>0,T1<T2 | C. | △H<0,T1>T2 | D. | △H>0,T1>T2 |
分析 由图象中的曲线可知T2曲线先达到平衡(先“拐”先“平”),所以T2为温度高的变化曲线;
由图象又可知温度升高,B%变大,平衡左移,故正反应为放热反应,△H<0.
解答 解:图象中T2曲线先达到平衡,说明T2曲线的条件下反应速率大,先“拐”先“平”温度高,升高温度反应速率加大可知,T2>T1,
温度升高,纵轴对应B%增大,说明升高温度,平衡向逆反应方向移动,逆反应为吸热反应,则正反应放热,△H<0,
故选A.
点评 本题考查化学平衡图象题,题目难度不大,做题时注意分析图象的从坐标和横坐标的物理量以及曲线的变化特点,结合外界条件对平衡移动的影响进行分析.

练习册系列答案
相关题目
5.下列各组离子在给定条件下能大量共存的是( )
| A. | 在pH=1溶液中:NH4+、K+、ClO-、Cl- | |
| B. | 在含有大量CO32-溶液中:NH4+、Na+、Cl-、H+ | |
| C. | 有NO3-存在的强酸性溶液中:NH4+、Ba2+、Fe2+、Br- | |
| D. | 在强碱溶液中:Na+、K+、CO32-、SiO32- |
6.酸雨的主要成分是H2SO4,以下是形成途径之一:①NO2+SO2→NO+SO3,②2NO+O2→2NO2,③SO3+H2O→H2SO4;以下叙述错误的是( )
| A. | 总反应可表示为2SO2+O2+2H2O$\stackrel{NO_{2}}{→}$2H2SO4 | |
| B. | 还可能发生的反应有4NO2+O2+2H2O→4HNO3 | |
| C. | NO2由反应N2+O2$\stackrel{放电}{→}$NO2生成 | |
| D. | 还可能发生的反应有4NO+3O2+2H2O→4HNO3 |
3.常温下,下列各组离子在指定条件下可能大量共存的是( )
| A. | NH4+、Na+、Br-、SO42- | |
| B. | Al3+、Cl-、OH-、HCO3- | |
| C. | pH=0的溶液中:ClO-、SO42-、Fe2+、K+ | |
| D. | 由水电离的c(OH-)=10-14mol•L-1的溶液中:CH3COO-、SO42-、Na+、NH4+ |
10.下列有关能量的叙述错误的是( )
| A. | 绿色植物进行光合作用时,将太阳能转化为化学能“储存”起来 | |
| B. | 物质发生化学反应过程中一定伴随着能量变化 | |
| C. | 可将反应“NaOH+HCl═NaCl+H2O”的化学能通过原电池转化为电能 | |
| D. | 化学反应使放热还是吸热,取决于生成物具有的总能量和反应物具有的总能量 |
7.下列说法错误的是( )
| A. | 双原子单质分子中的共价键一定是非极性键 | |
| B. | 含有离子键的化合物一定是离子化合物 | |
| C. | 含有共价键的化合物一定是共价化合物 | |
| D. | 在共价化合物中一定含有共价键 |
4.相同物质的量浓度的下列溶液,[NH4+]最大的是( )
| A. | NH4HCO3 | B. | NH4HSO4 | C. | NH4NO3 | D. | CH3COONH4 |
5.化学让生活更美好,生活中涉及化学的点点滴滴.下列叙述正确的是( )
| A. | 用食醋清洗热水瓶中的水垢;用米汤检验碘盐中含有碘酸钾 | |
| B. | 小苏打可中和胃酸,热纯碱溶液可除油污;小苏打和纯碱可以用石灰水鉴别 | |
| C. | 用丁达尔效应区别鸡蛋白溶液和食盐水 | |
| D. | “84消毒液”和洁厕剂能同时使用,除污垢效果更好 |
 铝、铁和铜是生产、生活中应用最广泛的金属材料.
铝、铁和铜是生产、生活中应用最广泛的金属材料.