题目内容
17.化学与人类生产、生活密切相关,下列说法正确的是( )| A. | 铝及其合金是生活中广泛使用的材料,通常用电解氯化铝的方法制取 | |
| B. | 采取“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”等方法,可提高空气质量 | |
| C. | 偏二甲肼[NH2N(CH3)2]是一种液体燃料,它的一种同分异构体可以是氨基酸 | |
| D. | 邻苯二甲酸二辛酯常用作增塑剂,对人体无害,可用作食品添加剂 |
分析 A.氯化铝不导电;
B.采用“静电除尘”“燃煤固硫”“汽车尾气催化净化”等方法可减少污染物,净化空气;
C.分子式相同结构不同的有机物互为同分异构体;
D.塑化剂对人体健康能造成很大的危害,不能用作食品添加剂.
解答 解:A.工业上用电解熔融氧化铝的方法制取铝,故A错误;
B.采用“静电除尘”“燃煤固硫”“汽车尾气催化净化”等方法可减少污染物,净化空气,可提高空气质量,故B正确;
C.氨基酸含有氧元素,偏二甲肼[NH2N(CH3)2]不含氧,所以二者不能形成同分异构体,故C错误;
D.塑化剂不能用作食品添加剂,故D错误;
故选:B.
点评 本题考查物质的性质及应用,为高频考点,把握物质的性质、性质与用途的关系为解答的关键,侧重分析与应用能力的考查,注意同分异构体概念,题目难度不大.

练习册系列答案
相关题目
8.甲醇是一种可再生能源,用途广泛,运用你学过的知识,回答下列有关甲醇的系列问题:
Ⅰ、与水一样,甲醇也能微弱电离:2CH5OH(l)?CH3OH2++CH3O-,它也存在一个类似Kw的离子积Km,且25℃时MKm=2.0×10-17.往一定量的甲醇中加入金属钠,则有关叙述不正确的是A
A.金属钠与甲醇反应比金属钠与水反应更强烈
B.结合H+的能力CH3O->OH-
C.温度不变,所得溶液中c(CH3O-)和c(CH3OH2+)的乘积为常数
D.所得溶液中c(Na+)+c(CH3OH2+)═c(CH3O-)
Ⅱ、已知在常温下常压下:
①2CH3OH+3O2(g)═2CO2(g)+4H2O(g)△H=-1275.6KJ/mol
②CO(g)+O2(g)═2CO2(g)△H=-566.0KJ/mol
③H2O(g)═H2O(l)△H=-44.0KJ/mol
请计算1mol甲醇不完全燃烧生成1mol一氧化碳和液态水放出的热量为442.8KJ.
Ⅲ、某同学设计了一个酸性甲醇燃料电池,并用该电池电解200mL一定浓度的NaCl与CuSO4混合溶液,其装置如图1.
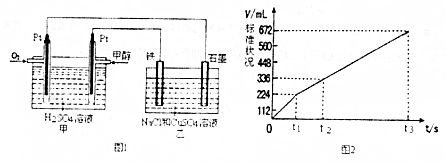
(1)写出甲中通入甲醇一极的电极反应式CH3OH-6e-+H2O=CO2↑+6H+.
(2)图2表示乙中阳极(选填“阴”或“阳”)产生气体的体积与电解时间的关系.当该极产生336mL气体时,理论上甲中消耗O2 224mL(标况).
Ⅳ、工业上常用两种方法生产甲醇:
方法一:CO(g)+2H2(g)?CH3OH(g)△H<0
(1)能说明该反应已达平衡状态的是B(填写序号字母).
A.n(CO):n(H2):n(CH3OH)=1:2:1
B.恒温恒容,气体总压强保持不变
C.H2的消耗速率与CH3OH的生成速率之比为2:1
D.恒温恒容,混合气体的密度保持不变
(2)下列措施能使容器中$\frac{n(C{H}_{3}OH)}{c(CO)}$增大的是C.
A.升高温度
B.将CH3OH从容器中分离出去一部分
C.体积不变,充入氢气
D.选用更有效的催化剂
E.体积不变,充入氦气,使体系压强增大
方法二:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0KJ/mol
某温度下,在容积均为1L的A、B两个容器中,按不同方式投入反应物,保持恒温恒容,达到平衡时的能量变化数据如表:
(1)A容器中的反应经10秒达到平衡,从反应开始至达到平衡,A中用H2表示平均反应速率为0.18 mol/(L•s).
(2)a=19.6;B容器中反应达到平衡时,CH3OH的转化率是40%.
(3)平衡后保持温度和体积不变,将A、B中的物质合并在A容器中,再次平衡时CH3OH的物质的量大于1.2mol.(选填“大于”、“小于”或“等于”)
Ⅰ、与水一样,甲醇也能微弱电离:2CH5OH(l)?CH3OH2++CH3O-,它也存在一个类似Kw的离子积Km,且25℃时MKm=2.0×10-17.往一定量的甲醇中加入金属钠,则有关叙述不正确的是A
A.金属钠与甲醇反应比金属钠与水反应更强烈
B.结合H+的能力CH3O->OH-
C.温度不变,所得溶液中c(CH3O-)和c(CH3OH2+)的乘积为常数
D.所得溶液中c(Na+)+c(CH3OH2+)═c(CH3O-)
Ⅱ、已知在常温下常压下:
①2CH3OH+3O2(g)═2CO2(g)+4H2O(g)△H=-1275.6KJ/mol
②CO(g)+O2(g)═2CO2(g)△H=-566.0KJ/mol
③H2O(g)═H2O(l)△H=-44.0KJ/mol
请计算1mol甲醇不完全燃烧生成1mol一氧化碳和液态水放出的热量为442.8KJ.
Ⅲ、某同学设计了一个酸性甲醇燃料电池,并用该电池电解200mL一定浓度的NaCl与CuSO4混合溶液,其装置如图1.

(1)写出甲中通入甲醇一极的电极反应式CH3OH-6e-+H2O=CO2↑+6H+.
(2)图2表示乙中阳极(选填“阴”或“阳”)产生气体的体积与电解时间的关系.当该极产生336mL气体时,理论上甲中消耗O2 224mL(标况).
Ⅳ、工业上常用两种方法生产甲醇:
方法一:CO(g)+2H2(g)?CH3OH(g)△H<0
(1)能说明该反应已达平衡状态的是B(填写序号字母).
A.n(CO):n(H2):n(CH3OH)=1:2:1
B.恒温恒容,气体总压强保持不变
C.H2的消耗速率与CH3OH的生成速率之比为2:1
D.恒温恒容,混合气体的密度保持不变
(2)下列措施能使容器中$\frac{n(C{H}_{3}OH)}{c(CO)}$增大的是C.
A.升高温度
B.将CH3OH从容器中分离出去一部分
C.体积不变,充入氢气
D.选用更有效的催化剂
E.体积不变,充入氦气,使体系压强增大
方法二:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0KJ/mol
某温度下,在容积均为1L的A、B两个容器中,按不同方式投入反应物,保持恒温恒容,达到平衡时的能量变化数据如表:
| 容器 | A | B |
| 反应物投入量 | 1molCO2(g)和3molH2(g) | 1molCH3OH(g)和1molH2O(g) |
| 反应能量变化 | 放出29.4KJ | 吸收aKJ |
(2)a=19.6;B容器中反应达到平衡时,CH3OH的转化率是40%.
(3)平衡后保持温度和体积不变,将A、B中的物质合并在A容器中,再次平衡时CH3OH的物质的量大于1.2mol.(选填“大于”、“小于”或“等于”)
5.下列实验对应的现象及结论均正确且两者具有因果关系的是( )
| 选项 | 实验 | 现象 | 结论 |
| A | 25℃,两片相同的Al片分别和等体积稀HNO3和浓HNO3反应 | 前者产生无色气体,后者产生红棕色气体,且后者反应更加剧烈 | 其他条件相同时,反应物浓度越大,反应速率越快 |
| B | 将无水乙醇和浓H2SO4的混合物加热至170℃,产生的气体通入酸性KMnO4溶液 | KMnO4溶液紫红色褪去 | 乙烯具有还原性 |
| C | SO2通入BaCl2溶液,然后滴入稀硝酸 | 有白色沉淀产生,加入稀硝酸后沉淀不溶解 | 所得沉淀为BaSO3,后转化为BaSO4 |
| D | 向盛有AgCl固体试管中加入一定量的0.01mol•L-1 KI溶液 | 固体由白色逐渐变为黄色 | Ksp(AgCl)>Ksp(AgI) |
| A. | A | B. | B | C. | C | D. | D |
12.25℃时,一定能大量共存的离子组是( )
| A. | 0.1mol/L的NH4HSO4溶液:Ba2+、Na+、NO3-、Cl- | |
| B. | 通KSCN溶液变红色的溶液:NH4+、Al3+、SO42-、Cl- | |
| C. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×1014的溶液:Ca2+、Na+、ClO-、NO3- | |
| D. | 与铝反应产生大量氢气的溶液:K+、Na+、CO32-、NO3- |
2.环丙叉环丙烷(A)结构特殊,根据如下转化判断下列说法正确的是( )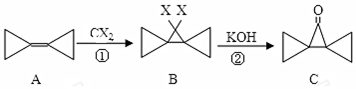
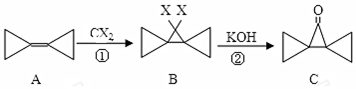
| A. | 反应①是加成反应 | B. | A的所有原子都在一个平面内 | ||
| C. | 反应②是消去反应 | D. | A的二氯代物只有2种 |







