题目内容
下列说法正确的是( )
| A、吸热反应都需加热才能发生 |
| B、在铁制品上镀铜时,铁制品作阳极,铜盐溶液作电镀液 |
| C、应用盖斯定律,可计算某些难以直接测量的反应焓变 |
| D、密闭容器中进行的可逆反应,气体压强不发生变化时说明反应一定达到化学平衡状态 |
考点:用盖斯定律进行有关反应热的计算,化学平衡状态的判断,电解原理
专题:化学反应中的能量变化,化学平衡专题,电化学专题
分析:A、反应放热还是吸热与反应条件无关,决定于反应物与生成物的能量差;
B、电镀时,被镀金属应作阴极;
C、CO燃烧的反应难以实现,可以通过C燃烧生成二氧化碳的焓变和CO燃烧生成二氧化碳的焓变利用盖斯定律求CO燃烧的焓变;
D、有些反应是反应前后气体体积没有变化的反应,如H2(g)+Cl2(g)═2HCl(g),所以容器中的压强一直未发生变化,故压强不变,不能证明达到了平衡状态.
B、电镀时,被镀金属应作阴极;
C、CO燃烧的反应难以实现,可以通过C燃烧生成二氧化碳的焓变和CO燃烧生成二氧化碳的焓变利用盖斯定律求CO燃烧的焓变;
D、有些反应是反应前后气体体积没有变化的反应,如H2(g)+Cl2(g)═2HCl(g),所以容器中的压强一直未发生变化,故压强不变,不能证明达到了平衡状态.
解答:
解:A.有的吸热反应不需要任何条件即可发生,如氯化铵和氢氧化钡晶体的反应,故A错误;
B.在铁制品上镀铜时,镀件铁制品为阴极,铜盐为电镀液,故B错误;
C.CO燃烧的反应难以实现,可以通过C燃烧生成二氧化碳的焓变和CO燃烧生成二氧化碳的焓变利用盖斯定律求CO燃烧的焓变,故C正确;
D.有些反应是反应前后气体体积没有变化的反应,如H2(g)+Cl2(g)═2HCl(g),所以容器中的压强一直未发生变化,故压强不变,不能证明达到了平衡状态,故D错误,
故选C.
B.在铁制品上镀铜时,镀件铁制品为阴极,铜盐为电镀液,故B错误;
C.CO燃烧的反应难以实现,可以通过C燃烧生成二氧化碳的焓变和CO燃烧生成二氧化碳的焓变利用盖斯定律求CO燃烧的焓变,故C正确;
D.有些反应是反应前后气体体积没有变化的反应,如H2(g)+Cl2(g)═2HCl(g),所以容器中的压强一直未发生变化,故压强不变,不能证明达到了平衡状态,故D错误,
故选C.
点评:本题考查反应热与反应条件的关系、电镀原理、化学反应平衡状态的判断等,难度不大.

练习册系列答案
相关题目
 如图是某有机物分子中C、H、O、N四种原子的成键方式示意图(短线表示单键或者双键).下列关于该有机物的说法正确的是.
如图是某有机物分子中C、H、O、N四种原子的成键方式示意图(短线表示单键或者双键).下列关于该有机物的说法正确的是.| A、在一定条件下,可以通过聚合反应生成高分子化合物 |
| B、分子式为C3H6NO2 |
| C、能和NaOH溶液反应,但不能和盐酸溶液反应 |
| D、不能和NaHCO3溶液反应生成CO2 |
NaNO2是一种食品添加剂,它与酸性KMnO4溶液可发生反应MnO4-+NO2-+X→Mn2++NO3-+H2O(未配平).下列叙述中正确的是( )
| A、生成1molNaNO3需消耗0.4molKMnO4 |
| B、反应过程中溶液的pH减小 |
| C、该反应中NO2-被还原 |
| D、X可以是盐酸 |
 W、Q、R、X、Y、Z六种元素的原子序数逐渐增大.已知W原子Is轨道上只有一个电子,Q、X原子p轨道的电子数分别为2和4,Z的原子序数为29,除Z外均为短周期主族元素,Y原子的价电子排布为(n+1)sn(n+1)pn.请回答下列问题:
W、Q、R、X、Y、Z六种元素的原子序数逐渐增大.已知W原子Is轨道上只有一个电子,Q、X原子p轨道的电子数分别为2和4,Z的原子序数为29,除Z外均为短周期主族元素,Y原子的价电子排布为(n+1)sn(n+1)pn.请回答下列问题: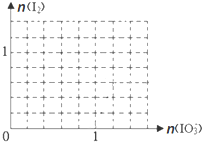 在生产生活中,卤族元素(F、Cl、Br、I)的单质及化合物用途广泛.
在生产生活中,卤族元素(F、Cl、Br、I)的单质及化合物用途广泛.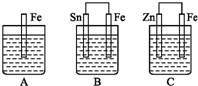 A,、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸,如图所示:
A,、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸,如图所示: