题目内容
19.“比较“是化学研究物质性质的基本方法之一,请运用比较法解答下列问题已知在一定条件下,过氧化钠几乎可与所有的常见气态非金属氧化物反应.
如:2Na2O2+2CO2═2Na2CO3+O2,Na2O2+CO=Na2CO3.
(1)试分别写出Na2O2与SO2、SO3反应的化学方程式2Na2O2+2SO2═2Na2SO4、2Na2O2+2SO3═2Na2SO4+O2
(2)当2molSO3参加反应时,转移电子的物质的量为2mol.
(3)通过比较可知:在氧化物中,当非金属元素处于最高价时,其氧化物与过氧化钠反应就有O2生成.
分析 (1)根据题干所给的过氧化钠的反应来书写;
(2)根据化合价升降情况来确定转移电子数;
(3)亚硫酸钠易被氧气氧化为硫酸钠,当生成亚硫酸钠时,不会产生氧气.
解答 解:(1)根据根据过氧化钠和二氧化碳的反应,可以推知过氧化钠和二氧化硫反应生成亚硫酸钠和氧气,亚硫酸钠易被氧气氧化为硫酸钠,即SO2+Na2O2=Na2SO4,三氧化硫和过氧化钠反应生成硫酸钠和氧气,即2SO3+2Na2O2=2Na2SO4+O2,
故答案为:2Na2O2+2SO2═2Na2SO4;2Na2O2+2SO3═2Na2SO4+O2;
(2)根据反应2Na2O2+2SO3═2Na2SO4+O2,该反应中化合价升高值=化合价降低值=2,即转移电子数为2,所以当2mol SO3(g)参加反应时,转移电子的物质的量为2mol,
故答案为:2;
(3)根据反应2Na2O+2CO2═2Na2CO3+O2,Na2O2+CO═Na2CO3和2Na2O2+2SO2═2Na2SO4,2Na2O2+2SO3═2Na2SO4+O2,比较可知:在氧化物中,当非金属元素处于最高价时,其氧化物与过氧化钠反应就有O2生成,
故答案为:最高.
点评 本题是一道氧化还原反应知识题目,要求学生具有分析和解决问题的能力,题目难度不大.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
9.下列说法正确的是( )
| A. | 按系统命名法,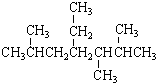 的名称为2,5,6-三甲基-4-乙基庚烷 的名称为2,5,6-三甲基-4-乙基庚烷 | |
| B. | 常压下,正戊烷、异戊烷、新戊烷的沸点依次增大 | |
| C. | 石油裂解可以得到氯乙烯,煤液化可得到焦炭、煤焦油、焦炉气等 | |
| D. | 1.0 molHC≡CCHO最多能与3.0 mol H2完全反应 |
10.下列除去杂质的方法中正确的是( )
| A. | 溴苯中混有溴,加入四氯化碳后,用分液漏斗分液 | |
| B. | 乙醇中混有乙酸,加入NaOH溶液后,用分液漏斗分液 | |
| C. | 乙烷中混有乙烯,加入氢气在一定条件下充分反应 | |
| D. | 苯甲醛中混有苯甲酸,加入生石灰,再加热蒸馏 |
7.25℃时,水的电离达到平衡:H2O?H++OH-,△H>0,下列叙述正确的是( )
| A. | 向水中加入固体CH3COONa,平衡正向移动,c(H+)降低 | |
| B. | 向水中加入少量固体硫酸氢钠,c(H+) 降低,Kw不变 | |
| C. | 向水中加入少量固体CH3COOH,平衡逆向移动,c(H+)降低 | |
| D. | 将水加热,Kw增大,pH不变 |
14.随着人们生活节奏的加快,方便的小包装食品已被广泛接受.为了延长食品的保质期,防止食品受潮及富脂食品氧化变质,在包装袋中应放入的化学物质是( )
| A. | 无水硫酸铜、蔗糖 | B. | 硅胶、硫酸亚铁 | C. | 食盐、蔗糖 | D. | 生石灰、食盐 |
4.实验操作的规范是实验的基本要求.下列实验操作正确的是( )
| A. |  给试管加热 | B. |  点燃酒精灯 | C. |  滴加液体 | D. |  称量10.05g固体 称量10.05g固体 |
8.下列各组离子在溶液中能大量共存的是( )
| A. | Al3+、K+、OH-、NO3- | B. | Ba2+、Na+、SO42-、OH- | ||
| C. | H+、K+、HCO3-、Cl- | D. | K+、Na+、SO42-、Cl- |
9.下列分子或离子在指定的分散系中能大量共存的一组是( )
| A. | 无色溶液:K+、Cu2+、NO3-、AlO2- | |
| B. | 空气:CH4、CO2、SO2、NO | |
| C. | 氢氧化铁胶体:H+、K+、S2-、Br - | |
| D. | 各离子物质的量浓度相等的溶液:K+、Mg2+、SO42-、NO3- |