题目内容
7.在500mL 0.2mol•L-1 稀硝酸中投入铜片1.92g,充分反应(反应前后溶液体积变化忽略不计)求:①产生的气体在标准状况下的体积0.448L
②反应后溶液中H+的物质的量浓度是0.04mol•L-1,NO3-的物质的量浓度是0.16mol/L.
③若使反应后溶液中Cu2+全部变为Cu(OH)2沉淀,至少应加入0.2mol•L-1 NaOH 溶液0.4L.
分析 发生3Cu+8HNO3 =3Cu(NO3)2+4H2O+2NO↑,n(Cu)=$\frac{1.92g}{64g/mol}$=0.03mol,n(HNO3)=0.5L×0.2mol/L=0.1mol,由反应可知硝酸过量,溶质只有硝酸钠时Cu2+全部变为Cu(OH)2沉淀,以此计算.
解答 解:①n(Cu)=$\frac{1.92g}{64g/mol}$=0.03mol,n(HNO3)=0.5L×0.2mol/L=0.1mol,由
3Cu+8HNO3 =3Cu(NO3)2+4H2O+2NO↑
0.03mol 0.08mol 0.03mol 0.02mol
可知0.03molCu参加反应消耗硝酸为0.08mol,生成的硝酸铜(铜离子)0.03mol,气体为 0.02mol,其体积为0.02mol×22.4L/mol=0.448 L,
故答案为:0.448L;
②由①知剩余的硝酸0.02mol,剩余的氢离子0.02mol,其浓度为$\frac{0.02mol}{0.5L}$=0.04 mol•L-1,NO3-的物质的量浓度是$\frac{0.1mol-0.02mol}{0.5L}$=0.16mol/L,
故答案为:0.04 mol•L-1;0.16mol/L;
③使反应后溶液中Cu2+全部变为Cu(OH)2沉淀,溶质为硝酸钠,溶液中硝酸根离子为0.08mol,则需要NaOH为0.08mol,氢氧化钠溶液体积为$\frac{0.08mol}{0.2mo/L}$=0.4L,
故答案为:0.4.
点评 本题考查氧化还原反应的计算,为高频考点,把握发生的反应、物质的量关系为解答的关键,侧重分析与计算能力的考查,注意铜离子完全沉淀时溶质为硝酸钠,题目难度不大.

 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案
(1)【SO2的制备】:用亚硫酸钠与浓硫酸反应制备SO2的装置如图1(夹持仪器省略).图中的装置错误的是C(填字母);D的作用是吸收二氧化硫尾气,防止污染空气.
(2)【探究SO2的性质】:根据SO2中S元素的化合价,预测并通过实验验证SO2的性质.实验可选用的实验药品有浓硫酸、Na2SO3固体、Na2S溶液、FeCl3溶液、品红溶液等.探究过程实验装置如图2.(夹持仪器省略)
①请完成下列表格.
| 药品 | 作用 | |
| A | FeCl3溶液 | 验证SO2的还原性 |
| B | Na2S溶液 | 验证二氧化硫的氧化性 |
| C | 品红溶液 | 验证二氧化硫的漂白性 |
③在上述装置中通入过量的SO2,为了验证A中发生了氧化还原反应,取A中溶液分成两份,并设计了如下实验:
方案一:往第一份试液中加入少量酸性KMnO4溶液,紫红色褪去;
方案二:往第二份试液中加入KSCN溶液,不变红,再加入新制的氯水,溶液变红.
上述方案不合理的是方案一,原因是过量的二氧化硫能溶于水,也能使高锰酸钾褪色.
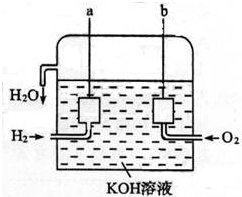
(3)【SO2的用途】:二氧化硫通常作为保护剂添加到葡萄酒中,有杀菌、抗氧化、改善风味和增酸的作用,但吸入过量二氧化硫对人体有害.我国国家标准规定葡萄酒中SO2的最大使用量为0.25g•L-1.图3为该小组对葡萄酒中的SO2进行收集与测量的装置.
①冷凝管中水的进口为:a(填“a”或“b”)
②A中加入200.00ml葡萄酒和适量盐酸,加热使SO2全部逸出并与B中H2O2完全反应,其化学方程式为SO2+H2O2=H2SO4.
③除去B中过量的H2O2,然后用0.0600mol•L-1NaOH标准溶液进行滴定,滴定至终点时,消耗NaOH溶液20.00ml,该葡萄酒中SO2含量为:0.192g•L-1.
(1)请按要求填充下表空格
| 实验名称 | 选用的仪器(填字母) | C或D中所盛试剂(填名称) | C或D中的现象 |
| 区别固体Na2CO3和NaHCO3 | BD | 澄清石灰水 | 澄清石灰水变浑浊 |
| 铜和浓硫酸反应 | AC | 品红溶液 | 溶液红色褪去 |
| 制备乙酸乙酯 | AC | 饱和碳酸钠溶液 | 上层有透明油状液体产生并有香味 |
A.Cu和浓硫酸反应时,可在装置D的试管口塞沾有碱液的棉花
B.加热已吸收Cu和浓硫酸反应生成物的溶液不能出现红色
C.制备乙酸乙酯时,装置C中球型管可以防倒吸
D.B装置可用于制备氨气.
| A. | 石头纸不宜在高温条件下生产 | |
| B. | 石头纸能耐酸和碱的腐蚀 | |
| C. | 石头纸不易燃烧 | |
| D. | 使用石头纸,有利于保护森林,且环保 |
| A. |  二溴乙烷 二溴乙烷 | B. |  1,3-二甲苯 1,3-二甲苯 | ||
| C. |  2-乙基丁烷 2-乙基丁烷 | D. | CH2=CH-CH=CH2 1,3一二丁稀 |
| A. | 红外光谱仪、核磁共振仪都不可用于鉴别1-溴丙烷和2-溴丙烷 | |
| B. | 用水无法鉴别乙醇、甲苯、硝基苯 | |
| C. | 用溴水鉴别乙醇、苯、苯酚、2-己烯 | |
| D. | 用KMnO4酸性溶液鉴别CH3CH=CHCH2OH和CH3CH2CH2CHO |
| A. | 研发可降解高分子材料,减少“白色污染” | |
| B. | 明矾和ClO2都能作为净水剂,其原理完全相同 | |
| C. | 海水淡化和工业生产及生活废水的再生利用,是解决缺水问题的有效途径 | |
| D. | 液氯罐泄漏时,可将其移入水塘中,并向水塘中加入生石灰 |