题目内容
10.铝土矿(主要成分为Al2O3,还含有SiO2、Fe2O3)是工业上制备氧化铝的主要原料.工业上提取氧化铝的工艺流程如下: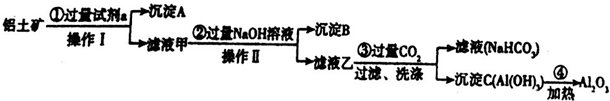
(1)沉淀A、B的成分分别是SiO2 、Fe(OH)3;步骤①中的试剂a是盐酸;
(2)步骤①②中加入试剂后进行的操作Ⅰ、Ⅱ的名称是过滤;
(3)步骤②中加入过量NaOH溶液发生反应的离子方程式是H++OH-=H2O、Fe3++3OH-=Fe(OH)3↓、Al3++4OH-=[Al(OH)4]-;
(4)步骤③中通入过量CO2气体而不加入过量盐酸的理由是过量盐酸能使生成的Al(OH)3溶解;
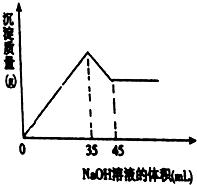
(5)准确称取8g铝土矿样品,加入一定量试剂a的溶液,使其中的Al2O3、Fe2O3恰好溶解;然后,向滤液中加入10mol•L-1的NaOH溶液,产生沉淀的质量与加入NaOH溶液的体积关系如图所示,则样品中Al2O3的百分含量为63.75%.
分析 铝土矿中加入过量试剂a,然后操作I得到沉淀A和滤液甲,则操作I为过滤,滤液甲中加入过量NaOH溶液操作II后得到沉淀B和滤液乙,操作II是过滤;Al2O3、SiO2能溶于强碱溶液而Fe2O3不溶于强碱溶液,SiO2不溶于稀盐酸而Fe2O3、Al2O3能溶于稀盐酸,根据图知,滤液甲中含有铝元素,则试剂a为稀盐酸,沉淀A为SiO2,滤液甲中溶质为氯化铝和氯化铁、HCl,沉淀B为Fe(OH)3,滤液乙中含有NaAlO2和NaOH、NaCl,向滤液乙中通入过滤二氧化碳得到滤液碳酸氢钠溶液,沉淀C为Al(OH)3,加热氢氧化铝得到氧化铝,
结合题目分析解答.
解答 解:铝土矿中加入过量试剂a,然后操作I得到沉淀A和滤液甲,则操作I为过滤,滤液甲中加入过量NaOH溶液操作II后得到沉淀B和滤液乙,操作II是过滤;Al2O3、SiO2能溶于强碱溶液而Fe2O3不溶于强碱溶液,SiO2不溶于稀盐酸而Fe2O3、Al2O3能溶于稀盐酸,根据图知,滤液甲中含有铝元素,则试剂a为稀盐酸,沉淀A为SiO2,滤液甲中溶质为氯化铝和氯化铁、HCl,沉淀B为Fe(OH)3,滤液乙中含有NaAlO2和NaOH、NaCl,向滤液乙中通入过滤二氧化碳得到滤液碳酸氢钠溶液,沉淀C为Al(OH)3,加热氢氧化铝得到氧化铝,
(1)通过以上分析知,A、B、a分别是SiO2、Fe(OH)3、盐酸,故答案为:SiO2 ;Fe(OH)3;盐酸;
(2)通过以上分析知,操作I、II都是过滤,故答案为:过滤;
(3)步骤②中加入过量NaOH溶液后,稀盐酸、铁离子、铝离子都和NaOH溶液反应,发生反应的离子方程式是H++OH-=H2O、Fe3++3OH-=Fe(OH)3↓、Al3++4OH-=[Al(OH)4]-,
故答案为:H++OH-=H2O、Fe3++3OH-=Fe(OH)3↓、Al3++4OH-=[Al(OH)4]-;
(4)步骤③中通入过量CO2气体而不加入过量盐酸的理由是过量的稀盐酸能溶解生成的氢氧化铝而得不到氢氧化铝,故答案为:过量盐酸能使生成的Al(OH)3溶解;
(5)根据图知,35-45mLNaOH溶液是溶解Al(OH)3,溶解Al(OH)3所需NaOH体积是生成Al(OH)3所需NaOH溶液体积的$\frac{1}{3}$,所以生成Al(OH)3所需NaOH溶液体积为30mL,35mLNaOH溶液时铝离子、铁离子完全沉淀,则生成氢氧化铁沉淀所需NaOH溶液体积为5mL,
根据关系式Al2O3~~~2Al(OH)3~~~6NaOH知,n(Al2O3)=$\frac{10mol/L×0.03L}{6}$=0.05mol,m(Al2O3)=0.05mol×102g/mol=5.1g,氧化铝质量分数=$\frac{5.1g}{8g}$×100%=63.75%,
故答案为:63.75%.
点评 本题考查物质制备,为高频考点,侧重考查学生分析判断及计算能力,明确流程图中发生的反应及各物质成分及其性质是解本题关键,知道(5)题关系式的正确运用,注意(5)题图中35mLNaOH溶液处生成的沉淀包含氢氧化铝和氢氧化铁,为易错点.

| 共价键 | 键能/ kJ•mol-1 | 共价键 | 键能/ kJ•mol-1 | 共价键 | 键能/ kJ•mol-1 |
| H-H | 436 | H-Br | 366 | Cl-Cl | 243 |
| H-O | 463 | H-I | 298 | Br-Br | 193 |
| H-Cl | 432 | O=O | 496 | I-I | 151 |
| A. | H2O中含有两个O-H共价键,故用氢气与氧气合成1 mol H2O放出的能量为926 kJ | |
| B. | 用单质合成1 mol H-Cl所放出的能量小于合成1 mol H-Br所放出的能量 | |
| C. | 当用表中卤素单质与氢气合成卤化氢时,所有的反应都是放热反应 | |
| D. | 合成溴化氢的热化学方程式为H2(g)+Br2(g)═2HBr(g)△H=+103 kJ•mol-1 |
 (1)某研究性学习小组用一定物质的量浓度的盐酸滴定10.00mL一定物质的量浓度的NaOH溶液,滴定时使用pH计精确测量滴定过程中溶液的pH变化(温度为25℃),并绘制出滴定过程中溶液pH的变化曲线如图所示.实验过程中需要使用的仪器有铁架台、滴定管夹、酸式滴定管、碱式滴定管、锥形瓶、烧杯,由图可计算出标准HCl溶液的物质的量浓度为2.5mol/L(忽略溶液混合时的体积变化).
(1)某研究性学习小组用一定物质的量浓度的盐酸滴定10.00mL一定物质的量浓度的NaOH溶液,滴定时使用pH计精确测量滴定过程中溶液的pH变化(温度为25℃),并绘制出滴定过程中溶液pH的变化曲线如图所示.实验过程中需要使用的仪器有铁架台、滴定管夹、酸式滴定管、碱式滴定管、锥形瓶、烧杯,由图可计算出标准HCl溶液的物质的量浓度为2.5mol/L(忽略溶液混合时的体积变化).(2)该小组同学在探究上述NaOH溶液与酚酞溶液作用时,发现了一个意外现象:向少量酚酞溶液中滴加NaOH溶液,开始时溶液变红色,但继续滴加NaOH溶液至一定量时红色消失.对此意外现象形成的原因,该小组同学分别提出了各自的看法并进行相应的实验设计.
甲:可能是NaOH溶液与空气中的CO2反应造成的.
乙:可能是溶液在碱性条件下继续与空气中的氧气反应造成的.
丙:可能与NaOH溶液的浓度有关.
【理论分析】①乙同学认为甲同学的猜想明显错误,他的理由是NaOH溶液与CO2反应生成的Na2CO3溶液也呈碱性,遇酚酞也会变红色.
【实验设计】②为证实乙同学的猜想,还需做如下实验,请完成下表:
| 实验步骤 | 设计此步骤的目的 |
| 将配制的NaOH溶液加热 | 除去溶液中溶解的氧气 |
| 在加热后的溶液中滴加酚酞,并在上方滴加一些植物油 | 隔绝空气 |
| 实验方案 | 观察到的现象和结论 |
| 分别配制不同浓度的NaOH溶液,然后各滴加2~3滴酚酞溶液,较稀的NaOH溶液中出现红色,很浓的NaOH溶液中无红色出现(或先变红色,一会儿红色消失) | 说明红色消失与NaOH溶液的浓度有关(或:向原红色消失的溶液中慢慢加入足量的水,红色重新出现;说明红色消失与NaOH溶液的浓度有关) |
已知:Na2S2O3在酸性溶液中不能稳定存在.有关物质的溶解度随温度变化曲线如图2所示.某研究小组设计了制备Na2S2O3•5H2O的装置图(如图1).
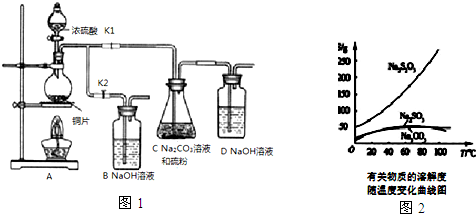
部分操作步骤如下:
①打开K1,关闭K2,向圆底烧瓶中加入足量浓硫酸,加热.
②C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少.当C中溶液的pH接近7时,即停止C中的反应,停止加热
③过滤C中的混合液,并将滤液进行处理,得到产品.
(1)步骤①中,圆底烧瓶中发生反应的化学方程式是Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
(2)步骤②中,“当C中溶液的pH接近7时即停止C中的反应”的原因是Na2S2O3在酸性溶液中不能稳定存在.“停止C中的反应”的操作是打开K2,关闭K1.
(3)步骤③中,“过滤”用到的玻璃仪器是烧杯、漏斗、玻璃棒(填仪器名称).将滤液进行处理过程是将滤液经过加热浓缩、冷却结晶、过滤、洗涤、烘干,得到产品.
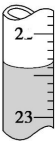
依据反应2S2O32-+I2→S4O62-+2I-,可用I2的标准溶液测定产品的纯度.取5.5g产品配制成100mL溶液.取10mL溶液,以淀粉溶液为指示剂,用浓度为0.050mol/L I2的标准溶液进行滴定,相关数据记录如表所示.
| 编号 | 1 | 2 | 3 | 4 |
| 溶液的体积/mL | 10.00 | 10.00 | 10.00 | 10.00 |
| 消耗I2标准溶液的体积/mL | 19.99 | 19.98 | 17.13 | 20.03 |
(5)Na2S2O3•5H2O在产品中的质量分数是90.2%.(计算结果请用百分数表示并保留1位小数)(Na2S2O3•5H2O的式量为248)
①NaOH②AgNO3③Na2CO3④FeCl2.
| A. | 只有②④ | B. | 只有④ | C. | 只有② | D. | 全部 |
 已知H2C2O4为二元中强酸.某化学兴趣小组为测定含Na2SO4、NaHC2O4和H2C2O4•2H2O的试样中各物质的质量分数,进行了如下实验:
已知H2C2O4为二元中强酸.某化学兴趣小组为测定含Na2SO4、NaHC2O4和H2C2O4•2H2O的试样中各物质的质量分数,进行了如下实验: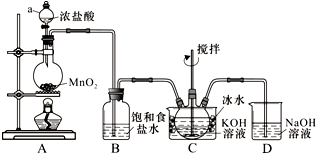
 天津港“8.12”爆炸事故中,因爆炸冲击导致氰化钠泄漏,可以通过喷洒双氧水或硫代硫酸钠溶液来处理,以减轻环境污染.
天津港“8.12”爆炸事故中,因爆炸冲击导致氰化钠泄漏,可以通过喷洒双氧水或硫代硫酸钠溶液来处理,以减轻环境污染.