题目内容
14.可以证明可逆反应N2+3H2?2NH3已达到平衡状态的是( )①一个N≡N键断裂的同时,有6个N-H键断裂
②v(N2)=0.2mol•L-1•min-1,v(NH3)=0.4mol•L-1•min-1
③保持其他条件不变时,体系压强不再改变;
④恒温恒容时,混合气体的密度保持不变;
⑤NH3、N2、H2的体积分数都不再改变.
| A. | ①②④ | B. | ①③⑤ | C. | ②③④ | D. | ③④⑤ |
分析 可逆反应N2+3H2?2NH3达到平衡状态时,正反应速率与逆反应速率相等,各组分的浓度、百分含量不再变化;注意该反应过程中混合气体的密度始终不变,据此进行判断.
解答 解:①一个N≡N键断裂的同时,有6个N-H键断裂,表明正逆反应速率相等,达到了平衡状态,故正确;
②v(N2)=0.2mol•L-1•min-1,v(NH3)=0.4mol•L-1•min-1,没有指出正逆反应,无法判断是否达到平衡状态,故错误;
③保持其他条件不变时,体系压强不再改变,表明各组分的浓度不再变化,达到了平衡状态,故正确;
④反应过程中密度始终不变,则不能根据混合气体的密度保持不变判断平衡状态,故错误;
⑤NH3、N2、H2的体积分数都不再改变,表明正逆反应速率相等,达到了平衡状态,故正确;
故选B.
点评 本题考查了化学平衡状态的判断,题目难度不大,明确化学平衡状态的特征为解答关键,注意掌握化学平衡及其影响因素,试题培养了学生的灵活应用基础知识的能力.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
4.下列关于有机物的说法不正确的是( )
| A. | 甲烷可以发生取代不能发生加成 | |
| B. | 乙烯可以做水果催熟剂 | |
| C. | 甲烷和乙烯都可以使酸性高锰酸钾溶液褪色 | |
| D. | 乙烯可以加聚制备聚乙烯 |
5.近年来,我国在超导材料研究方面居于世界领先地位,铊(Tl)是超导体的组成成分之一,铊位于第六周期第IIIA族.下列对铊的可能性质的推导正确的是( )
①原子半径比Al大 ②Tl(OH)3是两性氢氧化物
③Tl的阳离子氧化能力比Al的阳离子强 ④单质能与稀硝酸反应生成硝酸盐.
①原子半径比Al大 ②Tl(OH)3是两性氢氧化物
③Tl的阳离子氧化能力比Al的阳离子强 ④单质能与稀硝酸反应生成硝酸盐.
| A. | ①④ | B. | ②③ | C. | 只有① | D. | 只有④ |
2.某电池的总反应方程式为Pb+PbO2+4HBF4$?_{充电}^{放电}$2Pb(BF4)2+2H2,其中Pb(BF4)2、HBF4均是易溶于水的强电解质.下列说法中正确的是( )
| A. | 充电时,阳极附近溶液的pH增大 | |
| B. | 充电时,转移1 mol电子时阴极增加的质量为103.5 g | |
| C. | 放电时,BF4-向PbO2电极移动 | |
| D. | 放电时,正极的电极反应式为Pb+2e-+2H2O═Pb2++4OH- |
9.某物质转化关系如图,有关说法不正确的是( )
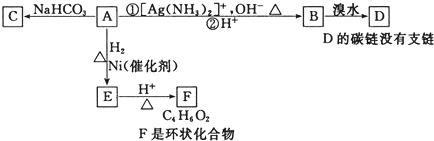

| A. | 化合物A中一定含有的官能团是醛基、羧基和碳碳双键 | |
| B. | 由A生成E发生还原反应 | |
| C. | F的结构简式可表示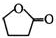 | |
| D. | 由B生成D发生加成反应 |
6.下列离子方程式正确的是( )
| A. | 铁与稀盐酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 在过氧化钠中加入稀硫酸:O22-+4H+═2H2O+O2↑ | |
| C. | 澄清石灰水与过量的小苏打溶液反应:Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32- | |
| D. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-═BaSO4↓ |
3.在标准状况下,等质量的CH4和CO2比较,下列说法中正确的是( )
| A. | 密度比4:1 | B. | 分子数之比为4:11 | ||
| C. | 体积比11:4 | D. | 物质的量之比为4:11 |
16.下列说法不正确的是( )
| A. | 高级脂肪酸甘油酯的碱性水解叫皂化反应 | |
| B. | 含淀粉或纤维素的物质可以酿酒 | |
| C. | 鸡蛋清的溶液中加入饱和氯化钠溶液,鸡蛋清凝聚,蛋白质变性 | |
| D. | 不同种类的氨基酸能以不同的数目和顺序彼此结合,形成更复杂的多肽化合物 |