题目内容
2.某电池的总反应方程式为Pb+PbO2+4HBF4$?_{充电}^{放电}$2Pb(BF4)2+2H2,其中Pb(BF4)2、HBF4均是易溶于水的强电解质.下列说法中正确的是( )| A. | 充电时,阳极附近溶液的pH增大 | |
| B. | 充电时,转移1 mol电子时阴极增加的质量为103.5 g | |
| C. | 放电时,BF4-向PbO2电极移动 | |
| D. | 放电时,正极的电极反应式为Pb+2e-+2H2O═Pb2++4OH- |
分析 原电池的总反应为:Pb+PbO2+4HBF4$?_{充电}^{放电}$2Pb(BF4)2+2H2O,故放电时负极反应为:Pb-2e-=Pb2+;正极反应:PbO2+2e-+4H+=Pb2++2H2O,阴离子移向负极,阳离子移向正极;充电时,阴极反应:Pb2++2e-=Pb,阳极反应:Pb2++2H2O-2e-=PbO2+4H+,阴离子移向阳极,阳离子移向阴极.据此分析.
解答 解:A.充电时,阳极反应:Pb2++2H2O-2e-=PbO2+4H+,产生大量氢离子,故阳极附近溶液的酸性增强,pH减小,故A错误;
B.放电时负极反应为:Pb-2e-=Pb2+,转移1mol 电子,阴极生成0.5mol Pb,即增重103.5g,故B正确;
C.放电时,BF4-向负极移动,故C错误;
D.由总反应可知放电时,正极发生还原反应,电极反应式为PbO2+2e-+4H+═pb2++2H2O,故D错误;
故选B.
点评 本题考查了原电池中电极反应式的书写和离子移动方向的判断,为高频考点,应注意的是在原电池中,阴离子移向负极,阳离子移向正极;在电解池中,阴离子移向阳极,阳离子移向阴极.

练习册系列答案
相关题目
12.室温时,向一密闭容器中充入2mol SO2和2mol O2,在一定条件下发生反应:2SO2+O2?2SO3,该反应达到最大限度时,下列说法正确的是( )
| A. | 正反应的速率为零 | B. | SO2完全转化为SO3 | ||
| C. | SO3的物质的量浓度不再变化 | D. | SO2、O2和SO3的物质的量浓度相等 |
13.相同温度下,50mL0.01mol的CH3COOH溶液与5mL0.1mol的CH3COOH溶液相比较,下列数值前者大于后者的是( )
| A. | 中和时所需KOH 的量 | B. | CH3COOH电离程度 | ||
| C. | H+的物质的量浓度 | D. | CH3COOH的物质的量 |
10.对下列各组物质关系的描述中不正确的是( )
| A. | O2和O3互为同素异形体 | |
| B. | ${\;}_{1}^{1}$H、${\;}_{1}^{2}$H和${\;}_{1}^{3}$H互为同位素 | |
| C. | CH2═CH2和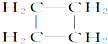 互为同系物 互为同系物 | |
| D. | 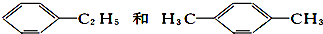 互为同分异构体 互为同分异构体 |
7.已知CoCln•mNH3可表示+3价Co的一种八面体配合物,若0.1mol配合物与足量AgNO3作用生成0.2mol AgCl沉淀,则m、n的值是( )
| A. | m=4,n=2 | B. | m=4,n=5 | C. | m=3,n=3 | D. | m=5,n=3 |
14.可以证明可逆反应N2+3H2?2NH3已达到平衡状态的是( )
①一个N≡N键断裂的同时,有6个N-H键断裂
②v(N2)=0.2mol•L-1•min-1,v(NH3)=0.4mol•L-1•min-1
③保持其他条件不变时,体系压强不再改变;
④恒温恒容时,混合气体的密度保持不变;
⑤NH3、N2、H2的体积分数都不再改变.
①一个N≡N键断裂的同时,有6个N-H键断裂
②v(N2)=0.2mol•L-1•min-1,v(NH3)=0.4mol•L-1•min-1
③保持其他条件不变时,体系压强不再改变;
④恒温恒容时,混合气体的密度保持不变;
⑤NH3、N2、H2的体积分数都不再改变.
| A. | ①②④ | B. | ①③⑤ | C. | ②③④ | D. | ③④⑤ |
4.锂硅合金-二硫化亚铁电池是一种高能电池,总反应式为:4Li+FeS2═Fe+2Li2S.用该电池为电源电解200mL浓度均为0.1mol/L 的NaCl和CuSO4的混合溶液,当电池消耗1.2g FeS2时,下列有关叙述不正确的是( )
| A. | 该电池不能用水溶液作为电解质 | |
| B. | 阳极产生的气体为Cl2和O2 | |
| C. | 电解后该溶液的pH=2 | |
| D. | 电源正极的电极反应式为:FeS2+4e-═Fe+2S2- |
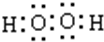 .
.