题目内容
15.下列离子方程式正确的是( )| A. | 硫酸铜溶液与氢氧化钡溶液反应:SO42-+Ba2+═BaSO4↓ | |
| B. | 将大理石投入到足量盐酸中:CO32-+2H+═CO2↑+H2O | |
| C. | 将Cl2通入KI溶液中:2I-+Cl2═2Cl-+I2 | |
| D. | 碳酸钠溶液显碱性:CO32-+H2O═HCO3-+OH- |
分析 A.漏掉了铜离子与氢氧根离子生成氢氧化铜的反应;
B.大理石的主要成分为碳酸钙,碳酸钙为难溶物,离子方程式中不能拆开;
C.氯气氧化性大于碘单质,二者反应生成氯化钾和碘单质;
D.碳酸根离子的水解反应为可逆反应,应该用可逆号.
解答 解:A.硫酸铜与氢氧化钡溶液反应生成硫酸钡和氢氧化铜沉淀,正确的离子方程式为:SO42-+Ba2++Cu2++2OH-=Cu(OH)2↓+BaSO4↓,故A错误;
B.将大理石投入到足量盐酸中,碳酸钙不能拆开,正确的离子方程式为:CaCO3+2H+=Ca2++H2O+CO2↑,故B错误;
C.将Cl2通入KI溶液中,反应生成氯化钾和碘单质,反应的离子方程式为:2I-+Cl2═2Cl-+I2,故C正确;
D.碳酸钠溶液中,碳酸根离子部分水解,溶液显碱性,正确的离子方程式为:CO32-+H2O?HCO3-+OH-,故D错误;
故选C.
点评 本题考查了离子方程式的判断,题目难度中等,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等;A为易错点,注意还生成了氢氧化铜沉淀.

练习册系列答案
相关题目
6.对盐的组成叙述正确的是( )
| A. | 都含有原子团 | B. | 都含有金属元素 | ||
| C. | 都不含氢元素 | D. | 都含有非金属元素 |
3.有FeO、Fe2O3的混合物若干克,在足量H2气流中加热充分反应,冷却后称得剩余固体比原混合物减轻0.8g;将等质量的原混合物与盐酸反应,欲使之完全溶解,至少需要1mol/L盐酸的体积为( )
| A. | 0.1L | B. | 0.2L | C. | 0.5L | D. | 1.0L |
7.金属M与AgNO3溶液反应的化学方程式为M+2AgNO3=M(NO3)2+2Ag.若M是铜,则下列说法错误的是( )
| A. | M的金属活动性比Ag强 | B. | 反应后溶液的质量增加 | ||
| C. | 金属M不可能变换成铝 | D. | 固体物质的质量增加了 |
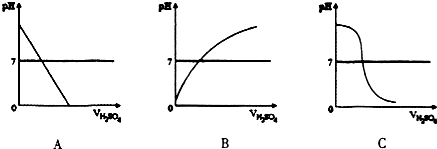
3.某同学进行中和反应实验:取适量的NaOH溶液于烧杯中,滴加几滴紫色石蕊试液.再逐渐滴加稀H2SO4测得溶液的pH及颜色变化情况如表:
(1)图中符合上述实验过程的图形是C
(2)当加人4ml稀H2SO4时,溶液显中性,溶液中的溶质为硫酸钠
(3)写出该中和反应的化学方程式2NaOH+H2SO4=Na2SO4+2H2O.
| 滴加稀H2SO4的体积ml | O | l | 2 | 3 | 4 | 5 | 6 | 7 |
| pH | 13.0 | 12.8 | 12.5 | 12.2 | 7.0 | 2.0 | 1.7 | 1.6 |
| 溶液颜色 | 蓝色 | 紫色 | 红色 | |||||

(2)当加人4ml稀H2SO4时,溶液显中性,溶液中的溶质为硫酸钠
(3)写出该中和反应的化学方程式2NaOH+H2SO4=Na2SO4+2H2O.
4.除去下列物质中所含少量杂质(括号内为杂质),所选用的试剂和分离方法能达到实验目的是( )
| 混合物 | 试剂 | 分离方法 | |
| A | 苯(苯酚) | 溴水 | 过滤 |
| B | 甲烷(甲醛) | 银氨溶液 | 洗气 |
| C | 乙酸乙酯(乙酸) | NaOH溶液 | 分液 |
| D | 乙醇(水) | 生石灰 | 蒸馏 |
| A. | A | B. | B | C. | C | D. | D |