题目内容
11.下列实验能达到预期目的是( )| 实验内容 | 实验目的 | |
| A | 某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成 | 该溶液中含有SO42- |
| B | 向 AgCl和水的混合物滴加KI的溶液,产生黄色沉淀 | 验证溶解度AgI小于AgCl |
| C | 淀粉和稀硫酸混合加热后,加新制Cu(OH)2悬浊加热至沸腾 | 检验淀粉是否水解完全 |
| D | 向NaOH溶液中滴加FeCl3饱和溶液 | 制备Fe(OH)3胶体 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.硝酸具有强氧化性,可与SO32-反应生成SO42-,且生成的白色沉淀可能为氯化银,原溶液中也可能含有银离子;
B.实现了沉淀的转化,溶解度越小越容易生成沉淀;
C.加入氢氧化铜悬浊液前必须用氢氧化钠转化稀硫酸,否则稀硫酸与氢氧化铜反应,无法检验;
D.氢氧化钠与氯化铁溶液反应生成的是氢氧化铁沉淀,无法获得氢氧化铁胶体.
解答 解:A.某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成,该白色沉淀可能为硫酸钡和AgCl,由于稀硝酸具有强氧化性,则原溶液中可能含有SO32-或Ag+,不一定含有SO42-,故A错误;
B.向AgCl和水的混合物滴加KI的溶液,产生黄色沉淀,说明AgCl沉淀转化成了更难溶AgI,据此可验证溶解度AgI小于AgCl,故B正确;
C.氢氧化铜浊液与醛的反应必须在碱性条件下进行,则加入氢氧化铜浊液前必须用氢氧化钠溶液中和稀硫酸,故C错误;
D.向NaOH溶液中滴加FeCl3饱和溶液,获得的是氢氧化铁沉淀,无法制备Fe(OH)3胶体,故D错误;
故选B.
点评 本题考查了化学实验方案的评价,题目难度中等,涉及离子检验、难溶物溶解平衡及沉淀转化、氢氧化铁胶体制备、淀粉水解等知识,明确常见化学实验基本操作方法即可解答,试题培养了学生的灵活应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.根据等电子原理判断,下列说法中正确的是( )
| A. | B3N3H6和苯是等电子体,B3N3H6分子中所有原子均不在同一平面上 | |
| B. | NO3-和CO32-是等电子体,均为平面正三角形结构 | |
| C. | H3O+和PCl3是等电子体,均为三角锥形 | |
| D. | CH4和NH4+是等电子体,均为正四面体形,键角均为60° |
20.下列有关物质结构的表述正确的是( )
(1)次氯酸的电子式: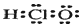
(2)Cl-的结构示意图: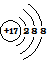
(3)二氧化硅的分子式:SiO2
(4)CO2的球棍模型示意图:
(5)熔化时NaHSO4的电离方程式为NaHSO4=Na++HSO4-
(6)乙酸的结构简式:C2H4O2
(7)质量数为37的氯原子:1737Cl.
(1)次氯酸的电子式:
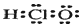
(2)Cl-的结构示意图:

(3)二氧化硅的分子式:SiO2
(4)CO2的球棍模型示意图:

(5)熔化时NaHSO4的电离方程式为NaHSO4=Na++HSO4-
(6)乙酸的结构简式:C2H4O2
(7)质量数为37的氯原子:1737Cl.
| A. | (2)(5) | B. | (1)(6) | C. | (4)(7) | D. | (3)(4) |
1.下列应用或事实与胶体的性质没有关系的是( )
| A. | 用明矾净化饮用水 | |
| B. | 用石膏或盐卤点制豆腐 | |
| C. | 在CuSO4溶液中逐滴加入烧碱溶液出现蓝色沉淀 | |
| D. | 用手电筒照向夜空中会出现一条光柱 |

 .
. .
. .
.