题目内容
1.下列说法或表示方法不正确的是( )| A. | 盖斯定律实质上是能量守恒定律的体现 | |
| B. | 在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,含0.5mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ | |
| C. | 由C(石墨)→C(金刚石)△H=+73 kJ/mol,可知石墨比金刚石稳定 | |
| D. | 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ/mol |
分析 A.盖斯定律是变化过程中能量变化和途径无关,与反应物和生成物能量有关,是能量守恒的体现;
B.浓硫酸溶于水放热;
C.能量越低越稳定;
D.2g氢气为1mol,热化学方程式中反应热数据错误.
解答 解:A.盖斯定律是变化过程中能量变化和途径无关,与反应物和生成物能量有关,可以看作是能量守恒的体现,故A正确;
B.浓硫酸溶于水放热,如稀溶液:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,则浓硫酸反应生成1mol水放出的热量大于57.3kJ,故B正确;
C.由C(石墨)-→C(金刚石)△H=+73 kJ/mol,可知石墨比金刚石的能量低,能量越低越稳定,故C正确;
D.2g氢气为1mol,热化学方程式中反应热数据错误,应为△H=-571.6 kJ/mol,故D错误.
故选D.
点评 本题考查化学反应与能量的变化,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握反应热的计算、比较方法,难度不大.

练习册系列答案
相关题目
6.常温下,将pH=3 的硫酸与pH=9的NaOH 溶液混合,若要得到PH=7 的溶液,混合时硫酸酸与NaOH溶液的体积比为( )
| A. | 1:200 | B. | 200:1 | C. | 100:1 | D. | 1:100 |
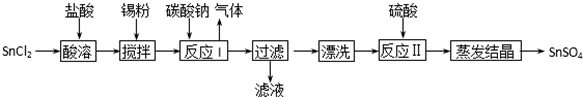
16. 硫酸是工业生产中重要的产品之一,在很多领域都有重要用途.回答下列问题:
硫酸是工业生产中重要的产品之一,在很多领域都有重要用途.回答下列问题:
(1)在硫酸工业生产中,我国采用黄铁矿为原料生产SO2,反应的化学方程式为4FeS2+11O2 $\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2;该反应在沸腾炉(填设备名称)中进行.
(2)为了有利于SO2转化为SO3,且能充分利用热能,可采用在有多层催化剂且有热交换器的接触室(填设备名称)中进行反应.在如图所示的装置中,C处流出的气体有SO3、SO2、O2,SO3进入吸收塔(填设备名称)中用98.3%的H2SO4吸收,得到浓硫酸或发烟硫酸.
(3)实验测得:SO2生成SO3的转化率与温度、压强的关系如表所示.已知400~600℃催化剂的催化效果较好,结合生产实际,选择最合适的生产条件是400℃,1个标准大气压
(4)欲提高SO2的反应速率和转化率,下列措施可行的是B(填选项字母).
A.向装置中通入氮气且保持体积不变
B.向装置中通入稍过量氧气且保持体积不变
C.添加更多的催化剂
D.降低温度,及时转移SO3
(5)吸收塔排出的尾气中,若SO2的含量超过500μL•L-1,就要加以处理,处理方法之一是用氨水洗涤烟气脱硫,用足量氨水吸收尾气中SO2的化学方程式为2NH3•H2O+SO2=(NH4)2SO3+H2O.
 硫酸是工业生产中重要的产品之一,在很多领域都有重要用途.回答下列问题:
硫酸是工业生产中重要的产品之一,在很多领域都有重要用途.回答下列问题:(1)在硫酸工业生产中,我国采用黄铁矿为原料生产SO2,反应的化学方程式为4FeS2+11O2 $\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2;该反应在沸腾炉(填设备名称)中进行.
(2)为了有利于SO2转化为SO3,且能充分利用热能,可采用在有多层催化剂且有热交换器的接触室(填设备名称)中进行反应.在如图所示的装置中,C处流出的气体有SO3、SO2、O2,SO3进入吸收塔(填设备名称)中用98.3%的H2SO4吸收,得到浓硫酸或发烟硫酸.
(3)实验测得:SO2生成SO3的转化率与温度、压强的关系如表所示.已知400~600℃催化剂的催化效果较好,结合生产实际,选择最合适的生产条件是400℃,1个标准大气压
| 压强 SO2转化率 温度 | 1.0×105Pa | 5.0×105Pa | 1.0×106Pa | 1.5×106Pa |
| 400℃ | 0.9961 | 0.9972 | 0.9984 | 0.9989 |
| 500℃ | 0.9675 | 0.9767 | 0.9852 | 0.9894 |
| 600℃ | 0.8528 | 0.8897 | 0.9276 | 0.9468 |
A.向装置中通入氮气且保持体积不变
B.向装置中通入稍过量氧气且保持体积不变
C.添加更多的催化剂
D.降低温度,及时转移SO3
(5)吸收塔排出的尾气中,若SO2的含量超过500μL•L-1,就要加以处理,处理方法之一是用氨水洗涤烟气脱硫,用足量氨水吸收尾气中SO2的化学方程式为2NH3•H2O+SO2=(NH4)2SO3+H2O.
6.下列说法不正确的是( )
| A. | 燃烧热是101kPa时,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量 | |
| B. | 工业上用点燃H2、Cl2混合气体的方法生产盐酸 | |
| C. | 金属钠着火时可用干燥的沙土来灭火 | |
| D. | 驰名世界的中国瓷器是硅酸盐材料 |
13.蒸馏水的制取及检验
| 实验目的 | 实验操作 | 现象 | 结论 |
| 自来水中离子检验 | 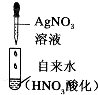 | 出现不溶于稀HNO3的沉淀 | 自来水中含氯离子 |
| 水的提纯 | 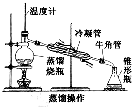 | 蒸馏烧瓶中水沸腾,冷凝管中有无色液体凝结,并通过冷凝管流入锥形瓶中 | 锥形瓶中收集到无色液体 |
| 蒸馏水中杂质离子的检验 | 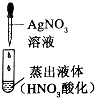 | 无明显现象 | 蒸馏水中不含氯离子 |
10.为使人们确知含碘物质的存在,研究性学习小组同学设计了一种简便的检验方法,利用该物质在酸性条件下与KI反应有单质碘生成的性质,选用下列生活常见的物质就可完成.请你从下列物质中选出合适的一组( )
①自来水 ②食醋 ③淀粉 ④食糖 ⑤碘化钾试纸 ⑥碘酒.
①自来水 ②食醋 ③淀粉 ④食糖 ⑤碘化钾试纸 ⑥碘酒.
| A. | ①③④⑤ | B. | ②③④⑤ | C. | ①③⑤⑥ | D. | ①②③⑤ |
11.下列变化需要加入氧化剂才能实现的是( )
| A. | NaOH→NaCl | B. | HCl→Cl2 | C. | H2SO4→H2 | D. | H2S→S |