题目内容
NA表示阿伏加德常数,下列说法正确的是( )
| A、2.24L HCl气体中含有0.1NA个HCl分子 |
| B、室温下,1molCH4含有的电子数为10NA |
| C、将0.1mol FeCl3溶于1L水中,所得溶液中含有0.1NA个Fe3+ |
| D、25℃时,1LpH=13的Ba(OH)2溶液中含有0.2NA个OH- |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.没有告诉在标准状况下,不能使用标况下的气体摩尔体积计算氯化氢的物质的量;
B.甲烷分子中含有10个电子,1mol甲烷中含有10mol电子.
C.氯化铁溶液中,铁离子部分水解,导致溶液中铁离子数目减少;
D.pH=13的氢氧化钡溶液中氢氧根离子浓度为0.1mol/L,则1L该溶液中含有0.1mol氢氧根离子.
B.甲烷分子中含有10个电子,1mol甲烷中含有10mol电子.
C.氯化铁溶液中,铁离子部分水解,导致溶液中铁离子数目减少;
D.pH=13的氢氧化钡溶液中氢氧根离子浓度为0.1mol/L,则1L该溶液中含有0.1mol氢氧根离子.
解答:
解:A.不是标准状况下,不能使用标况下的气体摩尔体积计算2.24L氯化氢的物质的量,故A错误;
B.1mol甲烷分子中含有10mol电子,含有的电子数为10NA,故B正确;
C.铁离子部分水解,则溶液中含有的铁离子小于0.1mol,所得溶液中含有的铁离子数目小于0.1NA,故C错误;
D.常温下pH=13的氢氧化钡溶液中,氢氧根离子浓度为:0.1mol/L,则1L该氢氧化钡溶液中含有氢氧根离子的物质的量为0.1mol,溶液中含有0.1NA个OH-,故D错误;
故选B.
B.1mol甲烷分子中含有10mol电子,含有的电子数为10NA,故B正确;
C.铁离子部分水解,则溶液中含有的铁离子小于0.1mol,所得溶液中含有的铁离子数目小于0.1NA,故C错误;
D.常温下pH=13的氢氧化钡溶液中,氢氧根离子浓度为:0.1mol/L,则1L该氢氧化钡溶液中含有氢氧根离子的物质的量为0.1mol,溶液中含有0.1NA个OH-,故D错误;
故选B.
点评:本题考查阿伏加德罗常数的应用,涉及了盐的水解、标况下气体摩尔体积的使用条件等知识,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确标况下 气体摩尔体积的使用条件,还要准确弄清分子、原子、原子核内质子中子及核外电子的构成关系.

练习册系列答案
相关题目
下列叙述正确的是( )
| A、氧化还原反应的实质是化合价发生变化 |
| B、氢氧化铁胶体可以发生电泳现象,是因为氢氧化铁胶体带有正电荷 |
| C、碱性氧化物一定是金属氧化物,酸性氧化物不一定是非金属氧化物 |
| D、同温同压下,相同体积的任何物质一定含有相同数目的分子 |
下列说法或表示法中正确的是( )
| A、质量为53 g的碳酸钠,其物质的量为0.5 mol |
| B、等质量的氢气和氧气比较,氢气所含的分子数较少 |
| C、与1.8 g水含有相同氢原子数的硫酸的物质的量为98 g |
| D、气体摩尔体积都约为22.4 L/mol |
设NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A、常温常压下,48gO3含有氧原子数为NA |
| B、标准状况下,1.8g的H2O中含有的电子数为NA |
| C、常温常压下,11.2L氧气所含的原子数为NA |
| D、2.8g铁与足量盐酸反应失去的电子数为0.15NA |
下列溶液中的c (Cl -)与100mL 1mol?L-1氯化铝溶液中的c (Cl-)相等( )
| A、300mL1mol?L-1 氯化钠溶液 |
| B、150mL2mol?L-1氯化铵溶液 |
| C、75mL3mol?L-1 氯化钙溶液 |
| D、10mL1.5mol?L-1 氯化钡溶液 |
下列溶液中,跟100mL 0.5mol/L NaCl溶液所含的Cl-物质的量浓度相同的是( )
| A、100mL 0.5mol/L MgCl2溶液 |
| B、200mL 0.25mol/L AlCl3溶液 |
| C、50mL 1mol/L NaCl溶液 |
| D、25mL 0.5mol/L HCl溶液 |
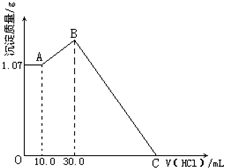 将FeCl3、AlCl3两种固体混合物溶于足量水后加入一定量的NaOH溶液,产生1.07g红褐色沉淀,再向所得浊液中逐滴滴加1.00mol?L-1HCl溶液,加入HCl溶液的体积与生产沉淀的关系如图所示,试回答:
将FeCl3、AlCl3两种固体混合物溶于足量水后加入一定量的NaOH溶液,产生1.07g红褐色沉淀,再向所得浊液中逐滴滴加1.00mol?L-1HCl溶液,加入HCl溶液的体积与生产沉淀的关系如图所示,试回答: