题目内容
下列说法中正确的是( )
| A、1 mol任何纯净物都含有相同的分子数 |
| B、1 mol氦气中约含有6.02×1023个氦原子 |
| C、1 mol水中含有8mol电子 |
| D、1 molNa的质量为23 g?mol-1 |
考点:摩尔质量,阿伏加德罗常数
专题:
分析:A、有些物质不是由分子构成的,如离子晶体、原子晶体;
B、1 mol氦气中约含有6.02×1023个氦原子;
C、1 mol水中应含有10mol电子;
D、1 molNa的质量应为23g.
B、1 mol氦气中约含有6.02×1023个氦原子;
C、1 mol水中应含有10mol电子;
D、1 molNa的质量应为23g.
解答:
解:A、物质的构成微粒有三种:分子、原子和离子,如氯化钠是由钠离子和氯离子构成的,不含氯化钠分子,错误;
B、氦气的分子式为He,为单原子分子,1mol氦气中约含有6.02×1023个氦原子,正确;
C、1mol水中应含有10mol电子,错误;
D、1molNa的质量应为23g,单位错,错误;
故选B.
B、氦气的分子式为He,为单原子分子,1mol氦气中约含有6.02×1023个氦原子,正确;
C、1mol水中应含有10mol电子,错误;
D、1molNa的质量应为23g,单位错,错误;
故选B.
点评:本题考查了物质的量的使用方法、阿伏加德罗常数的有关计算,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系.

练习册系列答案
 计算高手系列答案
计算高手系列答案
相关题目
胶体和浊液这三种分散系的根本区别是( )
| A、是否为大量分子或离子的集合体 |
| B、分散质微粒直径的大小 |
| C、是否能通过滤纸或有丁达尔现象 |
| D、是否均一、稳定、透明 |
4种短周期元素W、X、Y、Z的原子序数依次增大,其原子的最外层电子数之和为19,W和X元素原子内质子数之比为1:2,X2+和Z-离子的电子数之差为8,下列说法不正确的是( )
| A、与W相邻的同主族元素可制成重要的半导体材料 |
| B、元素原子半径从大到小的顺序是X、Y、Z |
| C、WZ4分子中W、Z原子通过共价键结合且最外层均达到8电子结构 |
| D、W、Y、Z元素对应的氢化物稳定性最强的是H2Y |
已知短周期主族元素A、B在周期表中的相对位置如右图(稀有气体除外),则下列说法不正确的是( )


| A、A一定是第2周期元素 |
| B、B的原子半径一定比A大 |
| C、B的金属性一定比A强 |
| D、A的熔沸点一定比B高 |
胶体区别于其他分散系的本质特征是( )
| A、胶体的分散质能通过滤纸空隙,而浊液的分散质不能 |
| B、胶体能产生丁达尔效应 |
| C、胶体分散质粒子直径在1nm~100nm之间 |
| D、胶体在一定条件下能稳定存在 |
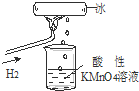 我校化学兴趣小组做了一个如图所示的实验,发现烧杯中酸性KMnO4溶液褪色.若将烧杯中的溶液换成含有少量KSCN的FeCl2溶液,溶液显红色.则该条件下( )
我校化学兴趣小组做了一个如图所示的实验,发现烧杯中酸性KMnO4溶液褪色.若将烧杯中的溶液换成含有少量KSCN的FeCl2溶液,溶液显红色.则该条件下( )| A、生成的水分子化学性质比较活泼 |
| B、H2燃烧生成了具有氧化性的物质 |
| C、H2被冷却为液态氢,液氢的水溶液具有还原性 |
| D、H2燃烧的产物中可能含有一定量的H2O2 |
下列实验问题的处理方法中,正确的是( )
| A、实验中不慎打破温度计,可用吹风机加快水银的蒸发 |
| B、在气体发生装置上直接点燃甲烷气体时,必须先检验甲烷的纯度 |
| C、实验结束后,将废液倒入下水道排出实验室,以免污染实验室 |
| D、燃着的酒精灯不慎碰翻失火,应立即用水扑灭 |