题目内容
9.下列离子方程中,书写正确的是( )| A. | Fe+2 H+=Fe3++H2↑ | B. | Fe3++Cu=Cu2++Fe2+ | ||
| C. | Cu+2H+=Cu2++H2↑ | D. | 2Fe3++Fe=3Fe2+ |
分析 A.铁与非氧化性酸反应生成的是亚铁离子;
B.电荷不守恒;
C.铜不能置换出氢;
D.三价铁与铁发生归中反应.
解答 解:A.铁与非氧化性酸(如盐酸)反应生成的是亚铁离子,离子方程式为:Fe+2H+=Fe2++H2↑,故A错误;
B.电荷不守恒,应配平为:2Fe3++Cu=Cu2++2Fe2+,故B错误;
C.铜不能置换出氢,不符合客观事实,故C错误;
D.三价铁与铁发生归中反应,离子方程式为:2Fe3++Fe=3Fe2+,故D正确;
故选D.
点评 本题考查了离子方程式的正误判断,为高考的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式的正误判断常用方法.

练习册系列答案
 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案
相关题目
19.有FeO、Fe2O3的混合物若干克,在足量氢气中加热充分反应,冷却后称得剩余固体比原混合物减轻了8克;将等质量的原混合物与盐酸反应,欲使之完全溶解,需要的盐酸的物质的量至少为( )
| A. | 0.5mol | B. | 0.1mol | C. | 2mol | D. | 1mol |
20.若ag O2含b个O2分子,则阿伏伽德罗常数为( )
| A. | $\frac{32a}{b}$ | B. | $\frac{32b}{a}$ | C. | $\frac{32b}{a}$mol-1 | D. | $\frac{32a}{b}$mol-1 |
14.某同学在探究废干电池内的黑色固体回收利用时,进行如图所示实验:
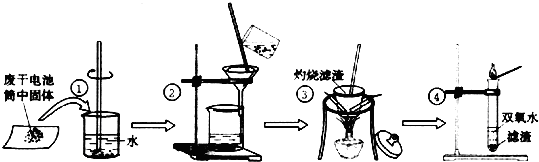
查阅教材可知,普通锌锰电池的黑色物质主要成分为MnO2、NH4Cl、ZnCl2等物质.请回答以下问题:
(1)操作①的名称是溶解;操作②的名称是过滤;
(2)操作③灼烧滤渣时所用主要仪器有酒精灯、玻璃棒、坩埚、泥三角 和三脚架;操作③灼烧滤渣中的黑色固体时,产生一种使澄清石灰水变浑浊的气体,由此推测滤渣中还存在的物质为C(碳).
(3)操作④的试管加入③中所得黑色滤渣,试管中迅速产生能使带火星的木条复燃的气体,据此可初步认定黑色固体为MnO2.
(4)该同学要对滤液的成分进行检验,以确认是否含有NH4Cl和ZnCl2,下面是他做完实验后所写的实验报告,请你写出其空白处的内容:

查阅教材可知,普通锌锰电池的黑色物质主要成分为MnO2、NH4Cl、ZnCl2等物质.请回答以下问题:
(1)操作①的名称是溶解;操作②的名称是过滤;
(2)操作③灼烧滤渣时所用主要仪器有酒精灯、玻璃棒、坩埚、泥三角 和三脚架;操作③灼烧滤渣中的黑色固体时,产生一种使澄清石灰水变浑浊的气体,由此推测滤渣中还存在的物质为C(碳).
(3)操作④的试管加入③中所得黑色滤渣,试管中迅速产生能使带火星的木条复燃的气体,据此可初步认定黑色固体为MnO2.
(4)该同学要对滤液的成分进行检验,以确认是否含有NH4Cl和ZnCl2,下面是他做完实验后所写的实验报告,请你写出其空白处的内容:
| 实验目的 | 操作 | 实验现象 | 结论 |
| 1.检验Cl- | 取少许滤液于试管中,加入硝酸酸化的硝酸银溶液 | 产生白色沉淀 | 含有Cl- |
| 2.检验NH4+ | 取少许滤液于试管中,加入浓氢氧化钠溶液并加热,将润湿的红色石蕊试纸置于试管口附近 | 石蕊试纸变蓝色 | 含有NH4+ k |
| 3.检验Zn2+ | 取少许滤液于试管中,加入稀氨水 | 先产生白色沉淀,继续加入氨水,沉淀又溶解 | 含有Zn2+ |
18.下列各选项中所述的两个量,前者一定大于后者的是( ) )
| A. | 室温下,1L0.3mol•L-1CH3COOH溶液和3L0.1 mol•L-1CH3COOH溶液中的H+数 | |
| B. | 纯水在25℃和80℃时的pH | |
| C. | 在NH3+NO→N2+H2O反应中,被氧化和被还原的N原子数 | |
| D. | 相同条件下,H2分别与Cl2、F2反应的反应速率 |
19.下列物质属于化合物的是( )
| A. | 空气 | B. | 氧气 | C. | 食盐水 | D. | 二氧化锰 |