题目内容
8.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )| A. | 25℃时,1LpH=12的Ba(OH)2溶液中含有的OH-数目为0.02NA | |
| B. | 室温下,14.0g乙烯和丁烯的混合气体中含有的C-H键数目为2NA | |
| C. | 0.1molFe在0.1molCl2中充分燃烧,转移的电子数为0.3NA | |
| D. | 标准状况下,22.4LCCl4中含有的分子数目为NA |
分析 A、pH=12的Ba(OH)2溶液中c(OH-)=0.01mol/L;
B、乙烯和丁烯的最简式均为CH2;
C、0.1mol铁和0.1mol氯气反应,氯气不足;
D、标况下四氯化碳为液态.
解答 解:A、pH=12的Ba(OH)2溶液中c(OH-)=0.01mol/L,故1L溶液中氢氧根的物质的量为n=CV=0.01mol/L×1L=0.01mol,个数为0.01NA个,故A错误;
B、乙烯和丁烯的最简式均为CH2,故14g混合物中含有的CH2的物质的量为n=$\frac{14g}{14g/mol}$=1mol,故含2molC-H键,个数为2NA个,故B正确;
C、0.1mol铁和0.1mol氯气反应,氯气不足,由于氯气反应后变为-1价,故0.1mol氯气转移0.2mol电子即0.2NA个,故C错误;
D、标况下四氯化碳为液态,故不能根据气体摩尔体积来计算其物质的量和分子数目,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目
7.已知钴(Co)的相对原子质量为59,一种钴的氧化物含+2价钴24.48%,+3价钴48.96%,则该钴的氧化物的化学式为( )
| A. | Co2O3 | B. | Co3O3 | C. | Co3O4 | D. | Co5O7 |
16.下列分散系能产生丁达尔效应的是( )
| A. | 稀豆浆 | B. | 稀硫酸 | C. | 氢氧化钠溶液 | D. | 食盐水 |
3.青蒿酸是合成青蒿素的原料,可以由香草醛合成:
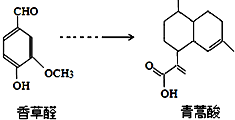
下列叙述正确的是( )

下列叙述正确的是( )
| A. | 青蒿酸分子中含有4个手性碳原子 | |
| B. | 在一定条件,香草醛可与HCHO发生缩聚反应 | |
| C. | 两种物质分别和H2反应,最多消耗H24mol和3mol | |
| D. | 可用FeCl3溶液或NaHCO3溶液鉴别化合物香草醛和青蒿酸 |
13.加热装有1mol NH3气体的定容密闭容器,在T1℃时,2NH3(g)?N2(g)+3H2 △H>0.
反应达到平衡时.N2的物质的量分数为X1;若起始时,在该容器中加热2mol NH3,在T2℃达到平衡时.N2的物质的量分数为x2,则下列关系一定正确的是( )
反应达到平衡时.N2的物质的量分数为X1;若起始时,在该容器中加热2mol NH3,在T2℃达到平衡时.N2的物质的量分数为x2,则下列关系一定正确的是( )
| A. | 若T1=T2,则x1>x2 | B. | 若T1=T2,则x1<x2 | C. | 若T1<T2,则x1=x2 | D. | 若T1<T2,则x1<x2 |
20. 有一包白色固体,可能含有Na2SO4、Na2CO3、BaCl2、NaOH中的一种或几种.下列根据实验事实得出的结论正确的是( )
有一包白色固体,可能含有Na2SO4、Na2CO3、BaCl2、NaOH中的一种或几种.下列根据实验事实得出的结论正确的是( )
 有一包白色固体,可能含有Na2SO4、Na2CO3、BaCl2、NaOH中的一种或几种.下列根据实验事实得出的结论正确的是( )
有一包白色固体,可能含有Na2SO4、Na2CO3、BaCl2、NaOH中的一种或几种.下列根据实验事实得出的结论正确的是( )| A. | 取样溶于水,有白色沉淀产生,说明原白色固体中一定有Na2SO4和BaCl2 | |
| B. | 取样溶于水,静置后测得上层清液的pH>7,说明原白色固体中一定有NaOH | |
| C. | 取样溶于水,有白色沉淀产生,过滤后向沉淀中滴加盐酸,沉淀的量与加入盐酸体积的关系如图1所示,则原白色固体中无Na2SO4 | |
| D. | 取样溶于水,有白色沉淀产生,过滤后向沉淀中滴加盐酸,产生气体的量与加入盐酸体积的关系如图2所示,则该白色固体中无NaOH |
