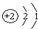题目内容
写出下列反应的离子方程式,并用单线桥法标明电子转移的方向和数目.
(1)Cu和AgNO3溶液反应
(2)向FeCl3 溶液中加入铁粉 生成FeCl2 .
(1)Cu和AgNO3溶液反应
(2)向FeCl3 溶液中加入铁粉 生成FeCl2
考点:离子方程式的书写
专题:
分析:(1)Cu和AgNO3溶液反应生成硝酸铜和金属银的反应中,Cu元素的化合价升高,Ag元素的化合价降低,该反应中转移2e-,以此来解答;
(2)FeCl3溶液中加入铁粉生成FeCl2的反应中,铁元素的化合价升高也降低,该反应中转移2e-,以此来解答.
(2)FeCl3溶液中加入铁粉生成FeCl2的反应中,铁元素的化合价升高也降低,该反应中转移2e-,以此来解答.
解答:
解:(1)Cu和AgNO3溶液反应生成硝酸铜和金属银,离子反应为:Cu+2Ag+═Cu2++2Ag,化合价升高值=化合价降低值=转移电子数=2,电子转移表示为: ,故答案为:
,故答案为: ;
;
(2)向FeCl3溶液中加入铁粉生成FeCl2,离子反应为:Fe+2Fe3+═3Fe2+,Fe元素化合价升高值=铁元素化合价降低值=转移电子数=2, ,
,
故答案为: .
.
 ,故答案为:
,故答案为: ;
;(2)向FeCl3溶液中加入铁粉生成FeCl2,离子反应为:Fe+2Fe3+═3Fe2+,Fe元素化合价升高值=铁元素化合价降低值=转移电子数=2,
 ,
,故答案为:
 .
.
点评:本题考查学生离子方程式的书写以及氧化还原反应中的电子转移知识,属于基本知识的考查题,难度不大.

练习册系列答案
相关题目
工业废气中的氮氧化物(如NO、NO2等,用通式NOx表示)是主要的大气污染物之一.为了保护环境,工业上常通入氨气与之发生如下反应:NOx+NH3-→N2+H2O来消除污染.有关此反应,下列说法中错误的是( )
| A、N2既是氧化产物又是还原产物 |
| B、当x=1时,每生成2.5 mol N2,被氧化的气体有3 mol |
| C、当x=2时,有1 mol气体被还原,转移电子4 mol |
| D、反应通式配平表示为:6NOx+4xNH3═(3+2x)N2+6xH2O |
A、B、C、D、E是5种短周期元素,其原子序数依次增大.A是周期表中原子半径最小的元素,B原子最外层电子数是次外层电子数的3倍,C、D、E处于同一周期,E与B处于同一族,C、D原子的核外电子数之和与B、E原子的核外电子数之和相等.下列说法正确的是( )
| A、元素B、C、D具有相同电子层结构的离子,其半径依次增大 |
| B、元素A不能与元素B形成化合物A2B2 |
| C、元素B、E分别与元素A形成的化合物的热稳定性:Am>AmE |
| D、元素D、E的最高价氧化物的水化物都是强酸 |
已知部分被氧化的镁条1.6g和足量的盐酸反应,在标准状况下生成了H2 1.12L,在跟盐酸反应前被氧化的镁是( )
| A、0.24g | B、0.64g |
| C、0.4g | D、1.2g |
据已有知识和元素性质递变规律来判断下列比较正确的是( )
| A、第二周期氢化物易燃性:CH4<NH3<H2O( ) |
| B、第三周期氢化物稳定性:SiH4>PH3>H2S>HCl |
| C、化合物毒性:若PH3>NH3,则H2S>H2O |
| D、氢化物的还原性:HF>H2O>NH3>CH4 |
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A、使紫色石蕊试剂显红色的溶液:NH4+、K+、[Al(OH)4]-、NO3- |
| B、稀HNO3溶液:Na+、Mg2+、SO42-、Cl- |
| C、FeCl3溶液:K+、Na+、I-、SO42- |
| D、由水电离产生的c(H+)=10-13 mol?L-1的溶液:K+、Na+、Cl-、HCO3- |