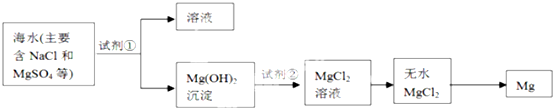
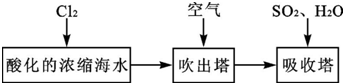
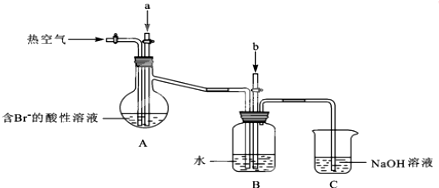
题目内容
8.下列有关金属的说法中,不正确的是( )| A. | 青铜、不锈钢和硬铝都是合金 | |
| B. | 铝可用于制造燃烧弹和信号弹 | |
| C. | 日用铝制品表面覆盖着氧化膜,对内部金属起保护作用,因此铝罐可久盛食醋 | |
| D. | 铜锈的主要成分是Cu2(OH)2CO3,可以用稀盐酸除铜锈 |
分析 A.青铜为Cu的合金,不锈钢为Fe的合金,硬铝为Al的合金;
B.制造燃烧弹和信号弹需燃烧时有耀眼白光,铝没有、镁条燃烧有;
C.铝非常活泼,表面极易形成氧化膜,保防了内部金属,但铝、氧化铝都能溶于食醋;
D.碱式碳酸铜与盐酸反应生成氯化铜、水和二氧化碳.
解答 解:A.青铜为Cu的合金,不锈钢为Fe的合金,硬铝为Al的合金,则青铜、不锈钢和硬铝都是合金,故A正确;
B.镁条燃烧发出耀眼白光,可以用于制造信号弹和焰火,铝没有,故B错误;
C.铝非常活泼,表面极易形成氧化膜,保防了内部金属,但Al表面的氧化铝能与醋酸反应,内部铝能与醋酸反应,易被腐蚀,铝罐不可以久盛食醋,故C错误;
D.铜锈的主要成分是Cu2(OH)2CO3,与盐酸反应:Cu2(OH)2CO3+4HCl=2CuCl2+3H2O+CO2↑,可以用稀盐酸除铜锈,故D正确;
故选BC.
点评 本题考查金属的性质,为高频考点,把握金属及化合物的性质、发生的反应、性质与用途的关系等为解答的关键,侧重应用能力的考查,题目难度不大.

练习册系列答案
相关题目
16.下列物质分类正确的是( )
| A. | BaSO4难溶于水,属于非电解质 | |
| B. | SO2能与碱反应生成盐和水,属于酸性氧化物 | |
| C. | NH4Cl组成中不含金属离子,不属于盐 | |
| D. | NaHSO4能电离出H+,NaHSO4属于盐 |
3.我国药学家屠呦呦因发现植物黄花蒿叶中含有抗疟疾的物质-青蒿素而荣获2015年诺贝尔奖.科学家对青蒿素的结构进行进一步改良,合成药效更佳的双氢青蒿素、蒿甲醚.下列说法不正确的是( )


| A. | 利用黄花蒿叶研究青蒿素结构的基本步骤为:分离、提纯→元素分析确定实验式→测定相对分子质量确定分子式→波谱分析确定结构式 | |
| B. | 双氢青蒿素在水中的溶解性大于青蒿素 | |
| C. | ①、②的反应类型分别为还原反应、取代反应 | |
| D. | 青蒿素转化为双氢青蒿素,手性碳个数不变 |
13.一种铁原子的原子核内有26个质子和30个中子,该原子的核外电子数为( )
| A. | 4 | B. | 26 | C. | 30 | D. | 56 |
20.25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )
| A. | 1 L 0.1 mol•L-1 (NH4)2Fe(SO4)2•6H2O溶液中:c(NH4+)+c(Fe2+)+c(H+)=c(OH-)+c(SO42-) | |
| B. | 0.1 mol•L-1的NH4Cl与0.1 mol•L-1的NH3•H2O等体积混合:c(NH4+)+2c(H+)=c(NH3•H2O)+2c(OH-) | |
| C. | pH=9.4、浓度均为0.1 mol•L-1的HCN与NaCN的混合溶液中:c(Na+)>c(CN-)>c(HCN)>c(OH-) | |
| D. | 0.1 mol•L-1 CH3COONa 溶液与0.05 mol•L-1盐酸等体积混合后的酸性溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) |
17.NA代表阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 常温常压下,17g甲基(-14CH3)所含的中子数为9NA | |
| B. | 10mL质量分数为98%的H2SO4,用水稀释至100mL,H2SO4的质量分数为9.8% | |
| C. | 热化学方程式C2H2(g)+$\frac{5}{2}$O2(g)=2CO2(g)+H2O(l)△H=-1300 kJ•mol-1,有 NA个水分子生成且为 液体时,吸收1300 kJ的能量 | |
| D. | 在H2O2+Cl2=2HCl+O2反应中,每生成32 g氧气,则转移2 NA个电子 |
 ,B中所含的化学键有离子键、共价键.又知X溶液显碱性,其原因是(用离子方程式表示)ClO-+H2O?HClO+OH-.
,B中所含的化学键有离子键、共价键.又知X溶液显碱性,其原因是(用离子方程式表示)ClO-+H2O?HClO+OH-.