题目内容
20.25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )| A. | 1 L 0.1 mol•L-1 (NH4)2Fe(SO4)2•6H2O溶液中:c(NH4+)+c(Fe2+)+c(H+)=c(OH-)+c(SO42-) | |
| B. | 0.1 mol•L-1的NH4Cl与0.1 mol•L-1的NH3•H2O等体积混合:c(NH4+)+2c(H+)=c(NH3•H2O)+2c(OH-) | |
| C. | pH=9.4、浓度均为0.1 mol•L-1的HCN与NaCN的混合溶液中:c(Na+)>c(CN-)>c(HCN)>c(OH-) | |
| D. | 0.1 mol•L-1 CH3COONa 溶液与0.05 mol•L-1盐酸等体积混合后的酸性溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) |
分析 A、电荷守恒分析解答;
B、根据质子守恒分析解答;
C、pH=9.4说明溶液呈碱性,则HCN与NaCN的混合溶液水解程度大于电离程度;
D、0.1 mol•L-1 CH3COONa 溶液与0.05 mol•L-1盐酸等体积混合得到物质的量浓度相等的CH3COONa、CH3COOH和NaCl,由此分析解答.
解答 解:A、电荷守恒可知:c(NH4+)+2c(Fe2+)+c(H+)=c(OH-)+2c(SO42-),故A错误;
B、根据质子守恒,可知:c(NH4+)+2c(H+)=c(NH3•H2O)+2c(OH-),故B正确;
C、pH=9.4说明溶液呈碱性,则HCN与NaCN的混合溶液水解程度大于电离程度,所以离子浓度大小为:c(Na+)>c(HCN)>c(CN-)>c(OH-),故C错误;
D、0.1 mol•L-1 CH3COONa 溶液与0.05 mol•L-1盐酸等体积混合得到物质的量浓度相等的CH3COONa、CH3COOH和NaCl,溶液呈酸性,则电离大于水解,所以c(CH3COO-)>0.025 mol•L-1,c(Cl-)=0.025 mol•L-1,c(CH3COOH)<0.025 mol•L-1,则:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+),故D正确;
故选BD.
点评 本题考查盐类水解及弱电解质电离,明确弱电解质电离特点以及溶液中电荷守恒和物料守恒是解本题关键,题目难度中等,侧重于考查学生的分析能力.

练习册系列答案
相关题目
10.用NA表示阿伏加德罗常数,下列说法中,正确的是( )
| A. | 标准状况下,22.4 LNH3中含有的氢原子数为3NA | |
| B. | 标准状况下,足量Na2O2和11.2LCO2反应,转移电子数目为NA | |
| C. | 常温常压下,16g CH4中所含中子数为10NA | |
| D. | 常温常压下,2.8g乙烯中含有碳氢键的数目为0.2NA |
11.下列说法中不正确的是( )
| A. | 甲硫醇(CH3SH)比甲醇(CH3OH)的熔点低的原因是甲醇分子间易形成氢键 | |
| B. | N-O键的极性比C-O键的极性小 | |
| C. | 氨易液化与氨分子间存在氢键有关 | |
| D. | H2O是一种非常稳定的化合物,这是由于氢键所致 |
8.下列有关金属的说法中,不正确的是( )
| A. | 青铜、不锈钢和硬铝都是合金 | |
| B. | 铝可用于制造燃烧弹和信号弹 | |
| C. | 日用铝制品表面覆盖着氧化膜,对内部金属起保护作用,因此铝罐可久盛食醋 | |
| D. | 铜锈的主要成分是Cu2(OH)2CO3,可以用稀盐酸除铜锈 |
5. Mg-H2O2电池可用于驱动无人驾驶的潜航器.该电池以海水为电解质溶液,示意图如下.该电池工作时,下列说法正确的是( )
Mg-H2O2电池可用于驱动无人驾驶的潜航器.该电池以海水为电解质溶液,示意图如下.该电池工作时,下列说法正确的是( )
 Mg-H2O2电池可用于驱动无人驾驶的潜航器.该电池以海水为电解质溶液,示意图如下.该电池工作时,下列说法正确的是( )
Mg-H2O2电池可用于驱动无人驾驶的潜航器.该电池以海水为电解质溶液,示意图如下.该电池工作时,下列说法正确的是( )| A. | Mg电极是该电池的正极 | |
| B. | H2O2在石墨电极上发生氧化反应 | |
| C. | 石墨电极附近溶液的OH-的物质的量浓度增大 | |
| D. | 溶液中Cl-向正极移动 |
12.下列各组气体,经充分反应后,原来的气体有剩余的是( )
| A. | 1molNH3和 1molHCl混合 | |
| B. | 1mol NO和 0.5 molO2混合 | |
| C. | 1molSO2和 1 molH2S混合 | |
| D. | 等体积的NO和NO2被足量烧碱溶液吸收 |
9.常温下一种烷烃A和一种单烯烃B组成混合气体,A和B分子中最多只含有4个碳原子,且B分子的碳原子数比A分子的多.120℃时取1L该混合气体与9LO2混合充分燃烧后得2.5LCO2.当恢复到120℃和燃烧前的压强时,体积增大6.25%.则混合气体中各成分的分子式为( )
| A. | CH4和C4H8 | B. | CH4和C3H6 | C. | C2H6和C3H6 | D. | C2H6和C4H8 |
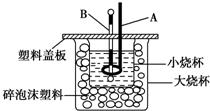 已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol.回答有关中和反应的问题.
已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol.回答有关中和反应的问题. 已知六方氮化硼类似于石墨的结构,如图所示,利用所学知识结合该图回答下列问题.
已知六方氮化硼类似于石墨的结构,如图所示,利用所学知识结合该图回答下列问题.