题目内容
已知:X、Y、Z为短周期元素,X、Y同周期,X和Z同主族,Y原子基态时的2p轨道上未成对的电子数最多,X的低价氧化物和Y单质分子的电子数相等.W2+的核外电子排布式为[Ar]3d9.
(1)XH3+是有机反应的重要中间体,其空间构型为 ,其中X原子的杂化轨道类型为 .
(2)Z的单质固态时属于 晶体,X和Z形成的化合物的晶体熔点比Z单质的晶体熔点高,原因是 .
(3)相同条件下,X、Y的最简单氢化物在水中溶解度较大的是 (填化学式),其主要原因是 .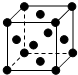
(4)W晶体的晶胞如右图,W原子的配位数为 .
(5)在含有W2+的溶液中,加入过量Y的最简单氢化物的水溶液,发生反应的离子方程式 .
(1)XH3+是有机反应的重要中间体,其空间构型为
(2)Z的单质固态时属于
(3)相同条件下,X、Y的最简单氢化物在水中溶解度较大的是

(4)W晶体的晶胞如右图,W原子的配位数为
(5)在含有W2+的溶液中,加入过量Y的最简单氢化物的水溶液,发生反应的离子方程式
考点:晶胞的计算,判断简单分子或离子的构型,晶体的类型与物质熔点、硬度、导电性等的关系,原子轨道杂化方式及杂化类型判断
专题:化学键与晶体结构
分析:X、Y、Z为短周期元素,X、Y同周期,X和Z同主族,Y原子基态时的2p轨道上未成对的电子数最多,则Y是N元素,X的低价氧化物和Y单质分子的电子数相等,且X和Y相同周期,则X是C元素,X和Z同主族且属于短周期元素,所以Z是Si元素,W2+的核外电子排布式为[Ar]3d9,则W是Cu元素.
解答:
解:X、Y、Z为短周期元素,X、Y同周期,X和Z同主族,Y原子基态时的2p轨道上未成对的电子数最多,则Y是N元素,X的低价氧化物和Y单质分子的电子数相等,且X和Y相同周期,则X是C元素,X和Z同主族且属于短周期元素,所以Z是Si元素,W2+的核外电子排布式为[Ar]3d9,则W是Cu元素.
(1)CH3+是有机反应的重要中间体,CH3+中价层电子对数是3且不含孤电子对,所以其空间构型为平面正三角形,其中C原子的杂化轨道类型为sp2,
故答案为:平面正三角形;sp2;
(2)Z是Si元素,Z的单质固态时属于原子晶体,X和Z形成的化合物的晶体熔点比Z单质的晶体熔点高,碳化硅和硅都是原子晶体,但硅硅键的键长大于碳硅键,所以碳化硅的熔点大于硅晶体,
故答案为:原子;碳化硅和硅都是原子晶体,但硅硅键的键长大于碳硅键;
(3)相同条件下,X、Y的最简单氢化物在水中溶解度较大的是NH3,主要原因是氨气和水分子间能形成氢键,从而促进氨气的溶解,甲烷和水不能形成氢键,且甲烷为非极性分子,所以甲烷不易溶于水,
故答案为:NH3;氨气和水分子间能形成氢键;
(4)Cu晶体的晶胞如图,Cu原子的配位数为3×8×
=12,
故答案为:12;
(5)在含有Cu2+的溶液中,加入过量N的最简单氢化物的水溶液,氨水和硫酸铜反应生成氢氧化铜蓝色沉淀,当氨水过量时,氨水和氢氧化铜反应生成可溶性的铜氨络合物,所以难溶物溶解得到深蓝色的透明溶液,涉及的离子方程式为:Cu2++2NH3?H2O═Cu(OH)2↓+2NH4+、Cu(OH)2+4NH3═[Cu(NH3)4]2++2OH-,
故答案为:Cu2++2NH3?H2O═Cu(OH)2↓+2NH4+、Cu(OH)2+4NH3═[Cu(NH3)4]2++2OH-.
(1)CH3+是有机反应的重要中间体,CH3+中价层电子对数是3且不含孤电子对,所以其空间构型为平面正三角形,其中C原子的杂化轨道类型为sp2,
故答案为:平面正三角形;sp2;
(2)Z是Si元素,Z的单质固态时属于原子晶体,X和Z形成的化合物的晶体熔点比Z单质的晶体熔点高,碳化硅和硅都是原子晶体,但硅硅键的键长大于碳硅键,所以碳化硅的熔点大于硅晶体,
故答案为:原子;碳化硅和硅都是原子晶体,但硅硅键的键长大于碳硅键;
(3)相同条件下,X、Y的最简单氢化物在水中溶解度较大的是NH3,主要原因是氨气和水分子间能形成氢键,从而促进氨气的溶解,甲烷和水不能形成氢键,且甲烷为非极性分子,所以甲烷不易溶于水,
故答案为:NH3;氨气和水分子间能形成氢键;

(4)Cu晶体的晶胞如图,Cu原子的配位数为3×8×
| 1 |
| 2 |
故答案为:12;
(5)在含有Cu2+的溶液中,加入过量N的最简单氢化物的水溶液,氨水和硫酸铜反应生成氢氧化铜蓝色沉淀,当氨水过量时,氨水和氢氧化铜反应生成可溶性的铜氨络合物,所以难溶物溶解得到深蓝色的透明溶液,涉及的离子方程式为:Cu2++2NH3?H2O═Cu(OH)2↓+2NH4+、Cu(OH)2+4NH3═[Cu(NH3)4]2++2OH-,
故答案为:Cu2++2NH3?H2O═Cu(OH)2↓+2NH4+、Cu(OH)2+4NH3═[Cu(NH3)4]2++2OH-.
点评:本题考查了晶胞的有关知识,正确推断元素是解本题关键,难点是配位数的判断,同时考查学生的空间想象能力,难度较大.

练习册系列答案
相关题目
相同质量的下列烃,完全燃烧时,耗氧量最多的是( )
| A、C3H6 |
| B、C4H10 |
| C、C6H6 |
| D、C7H12 |
室温下,下列各组离子在指定溶液中能大量共存的是( )
| A、饱和氯水中:Cl-、NO3-、Na+、SO32- |
| B、NaHCO3溶液中:Na+、CO32-、Al3+、NO3-、 |
| C、加入Al能放出H2的溶液中:Cl-、CO32-、NO3-、NH4+ |
| D、碱性溶液中:Na+、Ba2+ CO32-、AlO2- |
由乙炔和乙醛组成的混和气体,经测定其中碳的质量分数是72%,则混和气体中氧的质量分数是( )
| A、32.33% |
| B、22.65% |
| C、19.56% |
| D、2.14% |
从物质类别的通性角度分析,下列说法错误的是( )
| A、金属单质可以与非金属单质反应 |
| B、酸性氧化物可以与碱反应 |
| C、非金属单质应该与酸反应 |
| D、碱性氧化物可以与水反应 |
| E、… |
用NA表示阿伏加德罗常数,下列说法正确的是( )
| A、5.6g铁粉在过量的氯气中充分燃烧,失去的电子数为0.2NA |
| B、1mol/L NH4Cl溶液中,NH4+数目等于NA |
| C、22.4L CO(g)与1mol N2(g)所含的电子数目相等 |
| D、在标准状况下,2.24L二氧化硫与氧气混合气体中所含氧原子数为0.2NA |
 (1)某物质结构如图所示,其官能团是(填名称)
(1)某物质结构如图所示,其官能团是(填名称)