题目内容
18.10mL浓度为1moI.L-1的盐酸与过量的锌粉反应,若加入适量的下列溶液,能减慢反应速率但又不影响氢气生成量的是( )| A. | CuSO4 | B. | Na2CO3 | C. | K2SO4 | D. | Zn(NO3)2 |
分析 反应的实质为Zn+2H+═Zn2++H2↑,为了减缓反应速率,但又不影响生成氢气的总量,则减小氢离子的浓度但不能改变氢离子的物质的量即可,注意Zn过量,以此来解答.
解答 解:A.Zn可以置换出Cu,构成原电池,加快反应速率,故A错误;
B.加入碳酸钠溶液,与盐酸反应是二氧化碳,氢离子总量较小,生成氢气的量减少,故B错误;
C.加入硫酸钾溶液,氢离子浓度降低,反应速率减小,但氢离子总量不变,所以生成氢气总量不变,故C正确;
D.硝酸根离子在酸性条件下具有强氧化性,与锌反应生成NO,故D错误.
故选C.
点评 本题考查化学反应速率影响因素,题目难度不大,需注意生成氢气的量不变,注意A选项构成原电池,加快反应速率,明确化学反应速率及其影响因素为解答关键,试题培养了学生的灵活应用能力.

练习册系列答案
 全优测试卷系列答案
全优测试卷系列答案 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案
相关题目
8.下列物质中,属于天然高分子化合物的是( )
| A. | 聚乙烯 | B. | 蔗糖 | C. | 淀粉 | D. | 麦芽糖 |
9.下表列出了前20号元素中的某些元素性质的有关数据:
试回答下列问题:
(1)以上10种元素的原子中,失去核外第一个电子所需能量最少的是②(填写编号).
(2)上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是(写分子式)PCl3、CCl4.某元素R的原子半径为1.02×10-10m,该元素在周期表中位于第三周期ⅥA族.
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
| 原子半径(10-10m) | 1.52 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 0.71 |
| 最高价态 | +1 | +1 | - | +3 | +4 | +5 | +7 | +1 | +5 | - |
| 最低价态 | - | - | -2 | - | -4 | -3 | -1 | - | -3 | -1 |
(1)以上10种元素的原子中,失去核外第一个电子所需能量最少的是②(填写编号).
(2)上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是(写分子式)PCl3、CCl4.某元素R的原子半径为1.02×10-10m,该元素在周期表中位于第三周期ⅥA族.
6.阿魏酸化学名称为4-羟基-3-甲氧基肉桂酸,可以做医药、保健品、化妆品原料和食品添加剂,结构简式为 ,在阿魏酸溶液中加入合适试剂(可以加热),检验其官能团,下列试剂、现象、结论都正确的是 ( )
,在阿魏酸溶液中加入合适试剂(可以加热),检验其官能团,下列试剂、现象、结论都正确的是 ( )
 ,在阿魏酸溶液中加入合适试剂(可以加热),检验其官能团,下列试剂、现象、结论都正确的是 ( )
,在阿魏酸溶液中加入合适试剂(可以加热),检验其官能团,下列试剂、现象、结论都正确的是 ( ) | 选项 | 试剂 | 现象 | 结论 |
| A | 氧化铁溶液 | 溶液变蓝色 | 它含有酚羟基 |
| B | 银氨溶液 | 产生银镜 | 它含有醛基 |
| C | 碳酸氢钠溶液 | 产生气泡 | 它含有羧基 |
| D | 溴水 | 溶液褪色 | 它含有碳碳双键 |
| A. | A | B. | B | C. | C | D. | D |
13.下列物质中属于含有共价键的离子化合物的是( )
| A. | CaCl2 | B. | Na2O2 | C. | NaCl | D. | H2SO4 |
9.某科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)═2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度,n表示物质的量),根据如图可得出的判断结论正确的是( )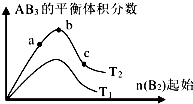

| A. | 反应速率a>b>c | |
| B. | 达到平衡时 A2的转化率大小为:b>a>c | |
| C. | 若T2>T1,则正反应一定是吸热反应 | |
| D. | 达到平衡时,AB3的物质的量大小为:b>c>a |
10. 在托盘天平的两托盘上各放一只烧杯,分别注人足量的稀盐酸,天平平衡.向左边烧杯中加入10克金属锌,向右边烧杯中加入10克金属镁,当反应停止后,天平指针的指向是( )
在托盘天平的两托盘上各放一只烧杯,分别注人足量的稀盐酸,天平平衡.向左边烧杯中加入10克金属锌,向右边烧杯中加入10克金属镁,当反应停止后,天平指针的指向是( )
 在托盘天平的两托盘上各放一只烧杯,分别注人足量的稀盐酸,天平平衡.向左边烧杯中加入10克金属锌,向右边烧杯中加入10克金属镁,当反应停止后,天平指针的指向是( )
在托盘天平的两托盘上各放一只烧杯,分别注人足量的稀盐酸,天平平衡.向左边烧杯中加入10克金属锌,向右边烧杯中加入10克金属镁,当反应停止后,天平指针的指向是( )| A. | 分度盘的左边 | B. | 分度盘的中间 | ||
| C. | 分度盘的右边 | D. | 三种情况都有可能 |
 已知1-丙醇和2-丙醇的结构简式如下:
已知1-丙醇和2-丙醇的结构简式如下: .
. ,你判断的依据是因为其分子有三种不同化学环境的氢原子,所以应该有三个氢原子的吸收峰,并且符合1:1:6的峰面积比关系.
,你判断的依据是因为其分子有三种不同化学环境的氢原子,所以应该有三个氢原子的吸收峰,并且符合1:1:6的峰面积比关系.