题目内容
14.若1g CO2中含有x个原子,则阿伏加德罗常数可表示为( )| A. | $\frac{1}{44}$ mol-1 | B. | $\frac{x}{22}$ mol-1 | C. | $\frac{3x}{44}$ mol-1 | D. | $\frac{44x}{3}$ mol-1 |
分析 结合n=$\frac{m}{M}$、NA=$\frac{N}{n}$及分子构成计算.
解答 解:1gCO2中含有原子x个,二氧化碳的物质的量为$\frac{1g}{44g/mol}$=$\frac{1}{44}$mol,原子的物质的量为$\frac{3}{44}$mol,则阿伏加德罗常数可表示为$\frac{x}{\frac{3}{44}mol}$=$\frac{44x}{3}$x,
故选D.
点评 本题考查物质的量的计算,为高频考点,把握质量、物质的量、微粒个数的关系为解答的关键,侧重分析与计算能力的考查,注意分子的构成,题目难度不大.

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
5.下列关于分散系的叙述中错误的是( )
| A. | 当光束通过下列分散系:有尘埃的空气、豆浆、墨水都能观察到丁达尔效应 | |
| B. | 溶液、胶体、浊液的根本区别是分散质微粒直径的大小 | |
| C. | 把1mL0.1mol/L三氯化铁溶液滴加入20mL沸水中,边加边振荡,可制得氢氧化铁胶体 | |
| D. | 胶体的稳定性介于溶液和浊液之间,属于介稳体系 |
2.下列关于能源的说法不正确的是( )
| A. | 通过煤的气化和液化获得洁净的燃料 | |
| B. | 加快核能、太阳能、沼气等新能源的开发利用 | |
| C. | 减少资源消耗,注重资源的重复使用、资源的循环再生 | |
| D. | 大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源 |
19.下列不能通过单质间反应而制得的物质是( )
| A. | CuCl2 | B. | CuO | C. | FeCl2 | D. | HCl |
6.0.1mol/L氨水溶液在稀释过程中,始终保持增大趋势的是( )
| A. | OH-的物质的量 | B. | c(H+) c(OH-) | C. | c(NH4+) | D. | c(OH-) |
3.下列说法正确的是( )
| A. | 丙烷是直链烃,所以分子中3个碳原子也在一条直线上 | |
| B. | 丙烯所有原子均在同一平面上 | |
| C. | 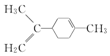 所有碳原子一定在同一平面上 所有碳原子一定在同一平面上 | |
| D. |  至少有16个原子共平面,至少8原子共线 至少有16个原子共平面,至少8原子共线 |
4.按照物质不同的分类方法,HNO3应属于( )
①酸 ②氢化物 ③氧化物 ④含氧酸 ⑤难挥发性酸⑥混合物 ⑦一元酸 ⑧化合物.
①酸 ②氢化物 ③氧化物 ④含氧酸 ⑤难挥发性酸⑥混合物 ⑦一元酸 ⑧化合物.
| A. | ①②③④⑤⑦⑧ | B. | ①④⑦⑧ | C. | ①⑥ | D. | ①④⑤⑦⑧ |
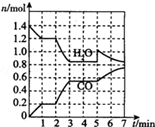 焦炭与CO、H2均是重要的能源,也是重要的化工原料.
焦炭与CO、H2均是重要的能源,也是重要的化工原料.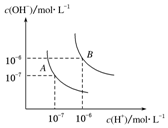 水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度.则100℃时1mol•L-1的NaOH溶液中,由水电离出的c(H+)=1×10-12mol•L-1,KW(25℃)<KW(100℃)(填“>”、“<”或“=”).
水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度.则100℃时1mol•L-1的NaOH溶液中,由水电离出的c(H+)=1×10-12mol•L-1,KW(25℃)<KW(100℃)(填“>”、“<”或“=”).