题目内容
15.通过强烈的相互作用形成金属键的微粒的是( )| A. | 阴阳离子 | B. | 原子 | ||
| C. | 分子 | D. | 金属阳离子和自由电子 |
分析 金属键的形成是通过金属离子与自由电子之间强烈的相互作用,由此分析解答.
解答 解:金属键的形成是通过金属离子与自由电子之间强烈的相互作用,而阴阳离子形成离子键,原子形成共价键,分子形成分子间作用力,故选D.
点评 本题主要考查化学键的概念与化合物的关系,侧重基本概念的考查,题目难度不大,注意把握金属键与其它化学键的区别.

练习册系列答案
相关题目
5.CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示:
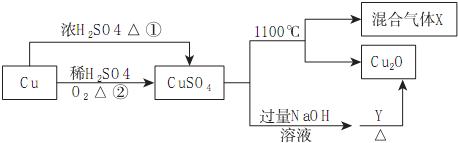
下列说法正确的是( )

下列说法正确的是( )
| A. | 途径①和途径②都体现了硫酸的酸性和氧化性 | |
| B. | Y可以是乙醛溶液 | |
| C. | CuSO4在1100℃分解所得气体X可能是SO2和SO3的混合气体 | |
| D. | 将CuSO4溶液蒸发浓缩、冷却结晶,可制得胆矾晶体 |
6.下列各组离子一定能大量共存的是( )
| A. | 某无色透明的酸性溶液:Cl-、Na+、MnO4-、SO42- | |
| B. | 能使pH试纸变深蓝色的溶液:Na+、NH4+、K+、CO32- | |
| C. | 加入过量NaOH溶液后可得到澄清的溶液:K+、Ba2+、HCO3-、Cl- | |
| D. | 常温下pH=12的溶液:K+、Ba2+、Cl-、NO3- |
3.下列离子方程式正确的是( )
| A. | 向氢氧化钠溶液中滴加醋酸:H++OH-═H2O | |
| B. | 碳酸氢钙溶液中加入氢氧化钠溶液:HCO3-+OH-═CO32-+H2O | |
| C. | 用氢氧化钠溶液除去铝表面的氧化膜:Al2O3+2OH-═2AlO2-+H2O | |
| D. | 在氯化亚铁溶液中通入氯气:2Fe2++Cl2═2Fe3++2Cl- |
20.模型在研究物质的结构和变化有很重要的作用.如图表示乙烯(C2H4)、甲醛(HCHO)和物质甲的分子结构模型.下列叙述错误的是( )


| A. | 物质甲的分子式为C2H4O2 | |
| B. | 若物质甲具有酸性,则乙烯和甲醛一定具有酸性 | |
| C. | 物质甲、乙烯和甲醛分子都具有双键 | |
| D. | 若三种物质在空气中完全燃烧,生成的产物相同 |
7.下列溶液中,呈酸性的是( )
| A. | Na2CO3 | B. | Na2SO4 | C. | NH4Cl | D. | BaCl2 |
5.化学与生产、生活、社会等密切相关.下列叙述正确的是( )
| A. | 碘遇淀粉变蓝,故在厨房里可用米汤检验加碘食盐中的碘 | |
| B. | 煤的气化、液化、干馏以及石油的分馏、裂化、裂解均属化学变化 | |
| C. | 明矾和氯气常用作自来水的净化与消毒,其作用原理相同 | |
| D. | 维生素C有还原性,故苹果汁中加入维生素C可防止变黄 |
 ;
;