题目内容
10.电导率是衡量电解质溶液导电能力大小的物理量.常温下,将相同体积的氢氧化钠溶液和醋酸溶液分别加水稀释,溶液的电导率随加入水的体积V(H2O)变化的曲线如下图所示.下列说法正确的是( )
| A. | 曲线I表示NaoH溶液加水稀释过程中溶液电导率的变化 | |
| B. | a、b、c三点溶液的pH:b>c>a | |
| C. | 将a、b两点溶液混合,所得溶液中:c(Na+)=c(CH3COO-)+c(CH3COOH) | |
| D. | 醋酸溶液稀释过程中,$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$不断增大 |
分析 稀释之前,两种溶液导电能力相等,说明离子浓度相等,由于醋酸为弱电解质,不能完全电离,则醋酸浓度大于氢氧化钠浓度,加水稀释时,醋酸进一步电离,Ⅰ为醋酸稀释曲线,Ⅱ为氢氧化钠稀释曲线,据此分析.
解答 解:A.加水稀释时,醋酸进一步电离,导电能力变化较小,则Ⅰ为醋酸稀释曲线,故A错误;
B.NaOH溶液显碱性,醋酸显酸性,导电能力越大,说明离子浓度越大,则a、b、c三点溶液的pH:c>b>a,故B错误;
C.将a、b两点溶液混合,由于醋酸浓度大于氢氧化钠浓度,反应后醋酸过量,溶液显酸性,则溶液中:c(Na+)<c(CH3COO-)+c(CH3COOH),故C错误;
D.醋酸溶液稀释过程中,Ka=$\frac{c(C{H}_{3}CO{O}^{-})×c({H}^{+})}{c(C{H}_{3}COOH)}$不变,而c(H+)减小,所以$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$不断增大,故D正确.
故选D.
点评 本题考查弱电解质的电离,题目难度中等,注意溶液离子浓度与导电性之间的关系,侧重于考查学生的分析能力和对基本原理的应用能力.

练习册系列答案
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案
相关题目
12.已知4NH3+5O2═4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则正确的关系是( )
| A. | $\frac{2}{3}$v(NH3)=v(H2O) | B. | 5v(O2)=6v(H2O) | C. | v(NH3):v(O2)=4:5 | D. | $\frac{5}{4}$v(O2)=v(NO) |
9.有机物甲、乙的结构如图所示.下列说法错误的是( )


| A. | 甲、乙互为同分异构体 | |
| B. | 甲、乙都能与溴的单质发生加成反应 | |
| C. | 甲、乙都能与金属钠反应生成氢气 | |
| D. | 一定条件下,甲、乙均能发生取代反应 |
5. 常温下,用0.10mol•L-1的NaOH溶液分别滴定体积均为50.00mL、浓度均为0.05mol•L-1的HClO、HF两种溶液,其滴定曲线如图所示.下列说法正确的是( )
常温下,用0.10mol•L-1的NaOH溶液分别滴定体积均为50.00mL、浓度均为0.05mol•L-1的HClO、HF两种溶液,其滴定曲线如图所示.下列说法正确的是( )
 常温下,用0.10mol•L-1的NaOH溶液分别滴定体积均为50.00mL、浓度均为0.05mol•L-1的HClO、HF两种溶液,其滴定曲线如图所示.下列说法正确的是( )
常温下,用0.10mol•L-1的NaOH溶液分别滴定体积均为50.00mL、浓度均为0.05mol•L-1的HClO、HF两种溶液,其滴定曲线如图所示.下列说法正确的是( )| A. | HClO的酸性比HF强 | |
| B. | V(NaOH溶液)=0 mL 时,对应溶液中:c(ClO-)=c(F-) | |
| C. | V(NaOH溶液)=12.50 mL 时,对应溶液中:c(ClO-)>c(F-) | |
| D. | V(NaOH溶液)=25.00mL时,对应溶液中:c(ClO-)<c(F-) |
15. 有X、Y、Z、W、A、B六种元素.其相关信息如下:
有X、Y、Z、W、A、B六种元素.其相关信息如下:
请回答下列有关问题:
(1)根据信息分析元素Y是F(填元素符号),A在元素周期表中的位置是第四周期VIII.
(2)BX3分子的中心原子采取的杂化类型是sp3.
(3)光谱证实单质 Z与强碱溶液反应生成[Z(OH)4]-,该原子的空间构型是正四面体型,[Z(OH)4]-离子中存在的化学键有ACD (填字母)
A.极性共价键 B.非极性共价键 C.配位键 D.σ键 E.π键
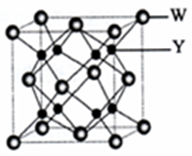
(4)Y与W可形成离子化合物,其晶胞结构如下图所示.W离子采取的堆枳方式是面心立方堆积,W离子的配位数为8,W离子的配位数为此空多余,Y离子占据空位四面体(填“四面体或八面体”).若该晶体的密度为dg•cm-3,则该晶胞中最近的Y离子与W离子间的距离是$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{78×4}{{N}_{A}×d}}$cm,(设NA为阿佛加德罗常数的值,只需列出计算表达式)
 有X、Y、Z、W、A、B六种元素.其相关信息如下:
有X、Y、Z、W、A、B六种元素.其相关信息如下:请回答下列有关问题:
| 元素 | 相关信息 | ||||||||||||||
| X | X原子的1s轨道上只有1个电子 | ||||||||||||||
| Y | Y是周期表中电负性最大的元素 | ||||||||||||||
| Z | Z是第三周期主族元素,其电离能l1~l7如下表所示(单位:KJ/mol)
| ||||||||||||||
| W | W是主族元素且与A同周期,其最外电子层上有两个运动状态不同的电子 | ||||||||||||||
| A | A是过渡元素,其基态原子的外围电子排布图为: | ||||||||||||||
| B | B元素基态原子的2p轨道中有三个未成对的电子 |
(2)BX3分子的中心原子采取的杂化类型是sp3.
(3)光谱证实单质 Z与强碱溶液反应生成[Z(OH)4]-,该原子的空间构型是正四面体型,[Z(OH)4]-离子中存在的化学键有ACD (填字母)
A.极性共价键 B.非极性共价键 C.配位键 D.σ键 E.π键
(4)Y与W可形成离子化合物,其晶胞结构如下图所示.W离子采取的堆枳方式是面心立方堆积,W离子的配位数为8,W离子的配位数为此空多余,Y离子占据空位四面体(填“四面体或八面体”).若该晶体的密度为dg•cm-3,则该晶胞中最近的Y离子与W离子间的距离是$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{78×4}{{N}_{A}×d}}$cm,(设NA为阿佛加德罗常数的值,只需列出计算表达式)
19.下列化学用语正确的是( )
| A. | 硫原子结构示意图: | |
| B. | 乙烯分子的结构式:CH2═CH2 | |
| C. | H2O2的电子式: | |
| D. | 碳酸氢钠的电离方程式NaHCO3=Na++HCO3- |
20.卤族元素随核电荷数的增加,下列叙述正确的是( )
| A. | 阴离子的还原性逐渐减弱 | B. | 与氢气化合条件越来越难 | ||
| C. | 单质的密度逐渐降低 | D. | 单质的氧化性逐渐增强 |

 ;加聚反应.
;加聚反应.