题目内容
7.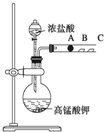 某研究性学习小组设计了一组实验来探究元素周期律.甲同学设计了如图装置来验证卤族元素性质的递变规律.A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润红纸.已知常温下浓盐酸与高锰酸钾能反应生成氯气.
某研究性学习小组设计了一组实验来探究元素周期律.甲同学设计了如图装置来验证卤族元素性质的递变规律.A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润红纸.已知常温下浓盐酸与高锰酸钾能反应生成氯气.(1)A处的离子方程式:Cl2+2Br-=2Cl-+Br2.
(2)B处现象为变蓝C处现象为红纸褪色.
分析 高锰酸钾和浓盐酸反应会产生氯气,氯气具有氧化性,能将溴离子,碘离子氧化为对应的,根据氧化性强的单质可以将氧化性弱的单质从其盐中置换出来结合反应产物确定实验现象.
解答 解:(1)根据题干信息:乙同学设计了如图装置来验证卤族元素性质的递变规律,所以乙同学的实验原理是同主族单质氧化性越强阴离子还原性越弱,对应元素非金属越强,高锰酸钾和浓盐酸反应会产生氯气,氯气具有氧化性,能将溴离子,碘离子氧化为对应的,即A处:Cl2+2Br-=2Cl-+Br2,故答案为:Cl2+2Br-=2Cl-+Br2;
(2)B处反应:Cl2+2I-=2Cl-+I2,所以B处的现象变蓝,剩余的氯气能使湿润红纸褪色,即 C处的现象是红色褪色,
故答案为:Cl2+2I-=2Cl-+I2;变蓝;红纸褪色.
点评 本题将元素及其化合物、元素周期律与非金属性强弱比较的实验设计结合起来,具有较强的综合性,有一定的难度,注意实验设计的原理和方法.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.设NA为阿伏加德罗常数的数值,下列说法中错误的是( )
| A. | 4.6g金属钠变成Na+,失去的电子数为0.2NA | |
| B. | 1.0L 1mol/L NaOH水溶液中含有的氧原子数为NA | |
| C. | 17g NH3所含的电子数为10NA | |
| D. | 9.5g MgCl2 溶于水所得溶液中含Cl-数为0.2NA |
2.某液态芳香烃的相对分子质量为106,其分子结构中含有一个苯环,具有这种结构的同分异构体共有( )
| A. | 2种 | B. | 5种 | C. | 4种 | D. | 3种 |
12.下列有关金属腐蚀与保护的说法正确的是( )
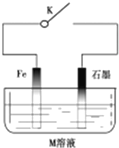

| A. | 常温下,断开K时,若M溶液为浓硫酸,则铁发生化学腐蚀 | |
| B. | 关闭K,若M为氯化钠,则铁极的电极反应式为O2+4e-+2H2O=4OH- | |
| C. | 关闭K,若M为硫酸铵,则石墨极的电极反应式为2H++2e-=H2↑ | |
| D. | 关闭K,若M溶液为海水,石墨换成铜或银,则叫外加电流的阴极保护法 |
19.某溶液中存在大量的OH-、CO32-、Cl-,该溶液中还可能大量存在的离子是( )
| A. | H+ | B. | NO3- | C. | Ag+ | D. | Ba2+ |
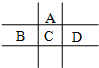 有A、B、C、D、E五种短周期元素,已知A、B、C、D四种元素在周期表中的位置如图所示,其中C元素的最高价氧化物对应的水化物浓溶液是一种常见的干燥剂.D在海水中大量富集.E的氧化物是两性氧化物,回答下列问题:
有A、B、C、D、E五种短周期元素,已知A、B、C、D四种元素在周期表中的位置如图所示,其中C元素的最高价氧化物对应的水化物浓溶液是一种常见的干燥剂.D在海水中大量富集.E的氧化物是两性氧化物,回答下列问题: