题目内容
10.实验室用共沉淀法制备纳米级Fe3O4的流程如下: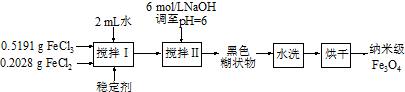
该方法的关键为促进晶粒形成,并控制晶体生长.试回答下列问题:
(1)该反应原理的是将一定量的FeCl3、FeCl2加入到6mol/L的NaOH溶液中,并调节pH=6时,便可得到黑色的糊状物Fe3O4,试用离子方程式可表示为该反应Fe2++2Fe3++8OH-=Fe3O4+4H2O.
(2)反应温度需控制在50℃,其方法是B.
A、酒精灯加热控制其温度为50℃B、用水浴加热,并控制水浴温度为50℃
(3)从黑色糊状物的悬浊液中分离出Fe3O4的实验操作是过滤.
(4)如何判断沉淀已经洗涤干净取最后的倾出液,取少量最后的倾出液于试管中,滴加几滴KSCN溶液,溶液不变血红色则已洗净(或取少量最后的倾出液于试管中,滴加几滴经稀硝酸酸化的硝酸银溶液,不产生沉淀则已洗净.).
(5)确认所得Fe3O4达到纳米级的简单实验是做丁达尔效应实验(用一支激光笔照射所得产物,如有一条光亮的通路,证明已达纳米级).
分析 (1)依据流程图分析制备反应过程,是氯化铁、氯化亚铁在氢氧化钠溶液中生成四氧化三铁、水、氯化钠;根据电荷守恒可写出该方程式;
(2)反应条件温度低于100°C,需要用水浴加热,水浴加热温度容易控制,加热均匀;
(3)分离固体和液体通常用过滤操作;
(4)水洗的主要作用是洗去吸附在黑色糊状物表面的Fe3+和Cl-,只要检验其中一个不存在即可;
(5)Fe3O4达到纳米级,即在溶液形成胶体,利用胶体的丁达尔效应证明Fe3O4达到纳米级;
解答 解:(1)由流程可知,生成Fe3O4的反应物为Fe2+、Fe3+和OH-,根据电荷守恒可写出该方程式为:Fe2++2Fe3++8OH-=Fe3O4+4H2O,
故答案为:Fe2++2Fe3++8OH-=Fe3O4+4H2O;
(2)低于100℃的温度控制通常用水浴加热法,故选B;
(3)分离固体和液体通常用过滤操作,从黑色糊状物的悬浊液中分离出Fe3O4的实验操作是过滤;
故答案为:过滤;
(4)水洗的主要作用是洗去吸附在黑色糊状物表面的Fe3+和Cl-,只要检验其中一个不存在即可,取最后的倾出液,取少量最后的倾出液于试管中,滴加几滴KSCN溶液,溶液不变血红色则已洗净(或取少量最后的倾出液于试管中,滴加几滴经稀硝酸酸化的硝酸银溶液,不产生沉淀则已洗净.),
故答案为:取最后的倾出液,取少量最后的倾出液于试管中,滴加几滴KSCN溶液,溶液不变血红色则已洗净(或取少量最后的倾出液于试管中,滴加几滴经稀硝酸酸化的硝酸银溶液,不产生沉淀则已洗净.);
(5)Fe3O4达到纳米级,即在溶液形成胶体,利用胶体的丁达尔效应证明Fe3O4达到纳米级,即做丁达尔效应实验(用一支激光笔照射所得产物,如有一条光亮的通路,证明已达纳米级),
故答案为:做丁达尔效应实验(用一支激光笔照射所得产物,如有一条光亮的通路,证明已达纳米级).
点评 本题考查了制备实验的设计,流程分析判断,反应条件的应用,实验基本操作的迁移应用能力,解答此类题的关键是一定要注意题中所给的信息,题目难度中等.

 互动英语系列答案
互动英语系列答案| A. | Cl2是氧化剂,NaOH是还原剂 | |
| B. | 被氧化的Cl原子和被还原的Cl原子的物质的量的比为5:1 | |
| C. | 每生成1mol的NaClO3转移6mol的电子 | |
| D. | Cl2既是氧化剂又是还原剂 |
| A. | 15 种 | B. | 16 种 | C. | 17 种 | D. | 18 种 |
| A. | 标准状况下,22.4 L由H2和O2组成的混合气体,所含分子总数为NA | |
| B. | 1mol Cl2参加反应,转移的电子数一定为2NA | |
| C. | 常温常压下,1 mol氖气含有的原子数为NA | |
| D. | 1L1 mol.L-l FeCl3溶液中Fe3+的数目小于NA |
请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样.若测得该试样所含水溶性无机离子的化学组分及其平均浓度如表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料.已知:
2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ•mol-1
2C(s)+O2(g)=2CO(g)△H=-221.0kJ•mol-1
则C(s)+H2O(g)=CO(g)+H2(g)△H=+131.3 kJ•mol-1.
②洗涤含SO2的烟气.以下物质可作洗涤剂的是AB.
A.Ca(OH)2 B.Na2CO3 C.CaCl2D.NaHSO3
(3)汽车尾气中有NOx和CO的生成:
①已知气缸中生成NO的反应为:N2(g)+O2(g)═2NO(g)△H>0
ⅰ.若1L空气含0.8molN2和0.2molO2,1300℃时在密闭容器内反应达到平衡,测得NO为8×10-4mol.计算该温度下的平衡常数K=4×10-6.
ⅱ.恒容密闭容器中,下列说法中能说明该反应达到化学平衡状态的是D
A混合气体的密度不再变化
B混合气体的平均分子量不在变化
C N2、O2、NO的物质的量之比为1:1:2
D氧气的百分含量不在变化
ⅲ.若升高温度,则平衡正向(填“正向”或“逆向”或“不”下同)移动,逆反应速率变大(填“变大”或“变小”或“不变”).
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO,2CO(g)=2C(s)+O2(g).已知该反应的△H>0,则该设想能否实现不能(填“能”或“不能”)?
(4)综上所述,你对该市下一步的环境建设提出的建议是燃煤脱硫;煤气化、液化后再燃烧;冬季供暖烧煤变成烧气;汽车尾气安装催化转换器.
| A. | 放电时,电池的负极反应为LiC6-e-═Li++C6 | |
| B. | 充电时,电池的正极反应为CoO2+Li++e-═LiCoO2 | |
| C. | 羧酸、醇等含活泼氢的有机物可用作锂离子电池的电解质 | |
| D. | 锂离子电池的比能量(单位质量释放的能量)低 |