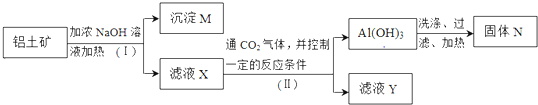
题目内容
10.已知:A(g)+2B(g)═C(g)+D(g)△H=a kJ•mol-1(a<0),下列说法正确的是( )| A. | A(g)的能量一定高于C(g)的能量 | |
| B. | 该反应不需要加热 | |
| C. | 1 mol A(g)和2 mol B(g)的总能量高于1 mol C(g)的能量 | |
| D. | 该反应表示:1 mol A(g)和2 mol B(g)在一定条件下反应放出的热量为a kJ |
分析 A(g)+2B(g)═C(g)+D(g)△H=a kJ•mol-1(a<0),可知反应物的总能量大于生成物的总能量,该反应为放热反应,以此来解答.
解答 解:A.为放热反应,反应物、生成物均有两种,不能确定A、C的能量大小,故A错误;
B.反应条件与反应热无关,不能确定是否需要加热,故B错误;
C.为放热反应,可知1 mol A(g)和2 mol B(g)的总能量高于1 mol C(g)和1molD(g)的能量,则1 mol A(g)和2 mol B(g)的总能量高于1 mol C(g)的能量,故C正确;
D.由热化学方程式的意义可知,该反应表示1 mol A(g)和2 mol B(g)在一定条件下完全转化生成1 mol C(g)和1molD(g)时放出的热量为a kJ,故D错误;
故选C.
点评 本题考查反应热与焓变,为高频考点,把握反应中能量变化、反应热与反应条件等为解答的关键,侧重分析与应用能力的考查,注意热化学方程式中为完全转化时的能量变化,题目难度不大.

练习册系列答案
相关题目
1.下列叙述正确的是( )
| A. | 某主族元素的最高价含氧酸为HnROm,则其气态氢化物一般是H2m-nR | |
| B. | 除第ⅡA族族外,其余各族都有非金属元素 | |
| C. | 同一主族相邻的两种元素的原子序数之差可能为16 | |
| D. | 同一短周期元素的原子半径从左到右逐渐减小 |
5. 在沙漠中喷洒聚丙烯酸酯,结构简式见图,可以实现沙漠变绿洲.下列对聚丙烯酸酯的说法中,不正确的是( )
在沙漠中喷洒聚丙烯酸酯,结构简式见图,可以实现沙漠变绿洲.下列对聚丙烯酸酯的说法中,不正确的是( )
 在沙漠中喷洒聚丙烯酸酯,结构简式见图,可以实现沙漠变绿洲.下列对聚丙烯酸酯的说法中,不正确的是( )
在沙漠中喷洒聚丙烯酸酯,结构简式见图,可以实现沙漠变绿洲.下列对聚丙烯酸酯的说法中,不正确的是( )| A. | 它没有固定的熔点 | |
| B. | 合成它的小分子化合物是CH2═CH-COOR | |
| C. | 在一定条件下能发生加成反应 | |
| D. | 它是由CH2═CH-COOR经加聚反应而得到 |
2.无机化学中也存在同分异构体,互为同分异构体的一组无机物是( )
| A. | NH4CNO与尿素CO(NH2)2 | |
| B. | H2O与D2O | |
| C. | Si(OH)4与H4SiO4 | |
| D. | [Cr(H2O)5Cl]Cl2•H2O与[Cr(H2O)4Cl2]Cl•2H2O |
19.如图表示吸收能量反应的图象是( )
| A. |  | B. |  | C. |  | D. |  |
20. 环上一溴代物的数目为(不考虑立体异构)( )
环上一溴代物的数目为(不考虑立体异构)( )
 环上一溴代物的数目为(不考虑立体异构)( )
环上一溴代物的数目为(不考虑立体异构)( )| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
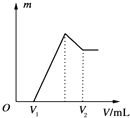 将0.1mol的镁、铝混合物溶于100mL、2mol•L-1的H2SO4溶液中,然后再滴加1mol•L-1的NaOH溶液.请回答:
将0.1mol的镁、铝混合物溶于100mL、2mol•L-1的H2SO4溶液中,然后再滴加1mol•L-1的NaOH溶液.请回答: