题目内容
19.下列物质的分子中,属于正四面体结构的是( )| A. | CCl4 | B. | CHCl3 | C. | CH2Cl2 | D. | CH3Cl |
分析 正四面体中,4个键的键长、键角都相等,一般只有同种元素构成的化学键才能完全相同.
解答 解:A、四氯化碳分子中碳原子价层电子对个数=4+×$\frac{1}{2}$(4-4×1)=4,且不含孤电子对,所以为四面体结构,只含有碳氯极性键,分子对称,所以为正四面体结构,故A正确;
B、三氯甲烷是3个氯原子取代了甲烷中3个氢原子,结构为四面体,含有碳氢、碳氯极性键,分子不对称,不是正四面体,故B错误;
C、二氯甲烷分子碳原子的价层电子对是4,且不含孤电子对,但氯原子和原子吸引电子的能力不同,所以二氯甲烷属于四面体结构,故C错误;
D、一氯甲烷是1个氯原子取代了甲烷中1个氢原子,结构为四面体,含有碳氢、碳氯极性键,分子不对称,不是正四面体,故D错误;
故选A.
点评 本题考查了微粒空间构型的判断,注意各元素原子、离子的大小不同,所形成的化学键长短也不同,难度中等.

练习册系列答案
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案
相关题目
9.下列四组物质的分子式都相同,按物质的分类方法属于同一类物质的是( )
| A. | 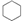 和CH2CH-CH2CH2CH2CH3 和CH2CH-CH2CH2CH2CH3 | B. | 正戊烷和新戊烷 | ||
| C. | CH3-O-CH3和CH3CH2OH | D. | 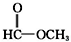 和 和 |
10.下列关于浓HNO3与浓H2SO4的叙述正确的是( )
| A. | 都具有强氧化性 | |
| B. | 在常温下都能与铜反应 | |
| C. | 露置于空气中都能形成白雾 | |
| D. | 在空气中长期露置,溶液质量均减轻 |
7.下列有关叙述正确的是( )
| A. | 苯分子是碳碳单双键交替相连的结构,因此苯环上碳碳键的键长都不相等 | |
| B. | 苯主要是从石油分馏而获得的一种重要化工原料 | |
| C. |  属于脂环化合物 属于脂环化合物 | |
| D. | 苯是一种无色液体,难溶于水,密度比水小 |
4.下列物质属于同系物的是( )
| A. |  和 和 | B. | CH3CH2Cl和CH2ClCH2Cl | ||
| C. | C2H6和C5H12 | D. | CH3CH2OH和CH3Cl |
3.草酸钴用途广泛,可用于指示剂和催化剂制备.一种利用水钴矿[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O4•2H2O工艺流程如图1:
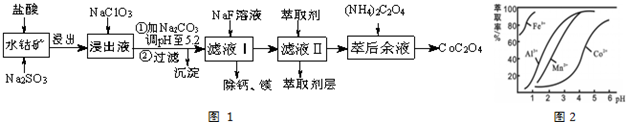
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
(1)浸出过程中加入Na2SO3的目的是将Co3+、Fe3+还原.该步反应的离子方程式为SO32-+2Fe3++H2O=SO42-+2Fe2++2H+.(写出一个)
(2)NaClO3的作用是将浸出液中Fe2+氧化为Fe3+.
(3)加Na2CO3调PH=5.2能使Fe3+、Al3+离子转化成氢氧化物沉淀,利用平衡移动原理分析的原因是因Fe3+和Al3+(用M3+代替)在水溶液中存在平衡M3++H2O?M(OH)3+3H+,加入碳酸钠后CO32-与H+结合生成难电离的HCO3-,使水解平衡右移而产生沉淀.
(4)萃取剂对金属离子的萃取率与pH的关系如图2所示.滤液Ⅱ中加入萃取剂的作用是除去Mn2+;使用萃取剂适宜的pH=B(填序号)左右.
A.2.0 B.3.0 C. 4.0
(5)滤液Ⅰ“除钙、镁”是将溶液中Ca2+与Mg2+转化为CaF2、MgF2沉淀而除去.已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10.当加入过量NaF后,所得滤液c(Mg2+)/c(Ca2+)=0.7.

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(2)NaClO3的作用是将浸出液中Fe2+氧化为Fe3+.
(3)加Na2CO3调PH=5.2能使Fe3+、Al3+离子转化成氢氧化物沉淀,利用平衡移动原理分析的原因是因Fe3+和Al3+(用M3+代替)在水溶液中存在平衡M3++H2O?M(OH)3+3H+,加入碳酸钠后CO32-与H+结合生成难电离的HCO3-,使水解平衡右移而产生沉淀.
(4)萃取剂对金属离子的萃取率与pH的关系如图2所示.滤液Ⅱ中加入萃取剂的作用是除去Mn2+;使用萃取剂适宜的pH=B(填序号)左右.
A.2.0 B.3.0 C. 4.0
(5)滤液Ⅰ“除钙、镁”是将溶液中Ca2+与Mg2+转化为CaF2、MgF2沉淀而除去.已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10.当加入过量NaF后,所得滤液c(Mg2+)/c(Ca2+)=0.7.
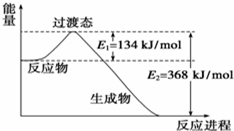 20世纪30年代,Eyring和Pzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态.如图是NO2和CO反应生成CO2和NO过程中的能量变化示意图,说明这个反应是放热(填“吸热”或“放热”)反应,NO2和CO的总能量大于(填“大于”、“小于”或“等于”)CO2和NO的总能量.
20世纪30年代,Eyring和Pzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态.如图是NO2和CO反应生成CO2和NO过程中的能量变化示意图,说明这个反应是放热(填“吸热”或“放热”)反应,NO2和CO的总能量大于(填“大于”、“小于”或“等于”)CO2和NO的总能量.