题目内容
10.下列关于浓HNO3与浓H2SO4的叙述正确的是( )| A. | 都具有强氧化性 | |
| B. | 在常温下都能与铜反应 | |
| C. | 露置于空气中都能形成白雾 | |
| D. | 在空气中长期露置,溶液质量均减轻 |
分析 A.浓HNO3与浓H2SO4都具有强氧化性;
B.浓硝酸、浓硫酸都具有强的氧化性,浓硫酸加热条件下与铜发生反应;
C.依据浓硝酸的挥发性和浓硫酸难挥发性解答;
D.依据浓硝酸的挥发性和浓硫酸吸水性解答.
解答 解:A.浓HNO3与浓H2SO4都是强氧化性的酸,具有强氧化性,故A正确;
B.浓硫酸在加热条件下与铜反应,浓硝酸常温下与铜发生反应,故B错误;
C.浓硝酸具有挥发性,敞口放置挥发的硝酸与水蒸气生成白雾,浓硫酸难挥发,不会形成白雾,故C错误;
D.浓硝酸具有挥发性和浓硫酸吸水性,所以在空气中长期露置,溶液质量前者减少,后者增加,故D错误;
故选A.
点评 本题考查了元素化合物知识,熟悉浓硫酸、浓硝酸的性质是解题关键,题目难度不大.

练习册系列答案
相关题目
20.甲烷与氯气发生取代反应,生成的四种不同的氯代物中,分子结构为正四面体型的是( )
| A. | CH3Cl | B. | CH2Cl2 | C. | CHCl3 | D. | CCl4 |
5.下列过程能同时生成两种盐的是( )
| A. | Na2O2投入水中 | B. | 铜片投入到FeCl3溶液中 | ||
| C. | NaHCO3溶液和NaOH溶液混合 | D. | 过量氨水加入到AlCl3溶液 |
2.下列过程属于化学变化的是( )
| A. | 石油的裂化 | B. | 氯水使有色布条褪色 | ||
| C. | 活性炭使红墨水褪色 | D. | 石油的分馏 |
19.下列物质的分子中,属于正四面体结构的是( )
| A. | CCl4 | B. | CHCl3 | C. | CH2Cl2 | D. | CH3Cl |
14.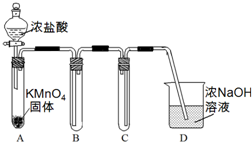 某兴趣小组利用文献资料设计方案对氯及其化合物进行探究.
某兴趣小组利用文献资料设计方案对氯及其化合物进行探究.
Ⅰ.用高锰酸钾和浓盐酸反应制取氯气
(1)该小组利用右图装置及试剂制备并收集适量Cl2,装置B、C的作用分别是收集氯气、防止D中的溶液进入B.
(2)制得的氯气中加入适量水,得到饱和氯水,
饱和氯水中含氯元素的微粒有Cl-、Cl2、ClO-、HClO(写出全部微粒).
(3)饱和氯水与石灰石的反应是制取较浓HC1O溶液的方法之一.在过量的石灰石中加入饱和氯水充分反应,有少量气泡产生,溶液浅黄绿色褪去,过滤,得到的滤液其漂白性比饱和氯水更强.
①滤液漂白性增强的原因是氯水中存在平衡:Cl2+H2O?HClO+HCl,CaCO3与盐酸反应使平衡正移,增大HClO的浓度,漂白效果增强(用化学平衡移动原理解释).
②饱和氯水与石灰石反应生成HC1O的方程式是CaCO3+2Cl2+H2O═2HC1O+CO2+CaCl2.
Ⅱ.ClO3-、Cl-和H+反应的探究
(4)KClO3、KCl与硫酸可以反应.该小组设计了系列实验研究反应条件对反应的影响,实验记录如下(实验在室温下进行):
①该系列实验的目的其他条件相同时,氢离子浓度不同对化学反应速率的影响.
②烧杯3取用硫酸的体积应为5 mL.
(5)该小组同学查资料得知:将氯酸钾固体和浓盐酸混合也能生成氯气,同时有大量ClO2生成;ClO2沸点为10℃,熔点为-59℃,液体为红色;Cl2沸点为-34℃,液态为黄绿色.设计最简单的实验验证Cl2中含有ClO2收集一试管气体,盖上胶塞,放入冰水混合物中,观察液体(或气体)颜色变化.
 某兴趣小组利用文献资料设计方案对氯及其化合物进行探究.
某兴趣小组利用文献资料设计方案对氯及其化合物进行探究.Ⅰ.用高锰酸钾和浓盐酸反应制取氯气
(1)该小组利用右图装置及试剂制备并收集适量Cl2,装置B、C的作用分别是收集氯气、防止D中的溶液进入B.
(2)制得的氯气中加入适量水,得到饱和氯水,
饱和氯水中含氯元素的微粒有Cl-、Cl2、ClO-、HClO(写出全部微粒).
(3)饱和氯水与石灰石的反应是制取较浓HC1O溶液的方法之一.在过量的石灰石中加入饱和氯水充分反应,有少量气泡产生,溶液浅黄绿色褪去,过滤,得到的滤液其漂白性比饱和氯水更强.
①滤液漂白性增强的原因是氯水中存在平衡:Cl2+H2O?HClO+HCl,CaCO3与盐酸反应使平衡正移,增大HClO的浓度,漂白效果增强(用化学平衡移动原理解释).
②饱和氯水与石灰石反应生成HC1O的方程式是CaCO3+2Cl2+H2O═2HC1O+CO2+CaCl2.
Ⅱ.ClO3-、Cl-和H+反应的探究
(4)KClO3、KCl与硫酸可以反应.该小组设计了系列实验研究反应条件对反应的影响,实验记录如下(实验在室温下进行):
| 烧杯编号 | 1 | 2 | 3 | 4 |
| 氯酸钾饱和溶液 | 1mL | 1mL | 1mL | 1mL |
| 氯化钾固体 | 1g | 1g | 1g | 1g |
| 水 | 8mL | 6mL | 3mL | 0mL |
| 硫酸(6mol/L) | 0mL | 2mL | (5)mL | 8mL |
| 现象 | 无现象 | 溶液呈浅黄色 | 溶液呈黄绿色,生成浅黄绿色气体 | 溶液呈黄绿色, 生成黄绿色气体 |
②烧杯3取用硫酸的体积应为5 mL.
(5)该小组同学查资料得知:将氯酸钾固体和浓盐酸混合也能生成氯气,同时有大量ClO2生成;ClO2沸点为10℃,熔点为-59℃,液体为红色;Cl2沸点为-34℃,液态为黄绿色.设计最简单的实验验证Cl2中含有ClO2收集一试管气体,盖上胶塞,放入冰水混合物中,观察液体(或气体)颜色变化.
 ;若XY2为共价化合物时,其结构式为:S=C=S.
;若XY2为共价化合物时,其结构式为:S=C=S.