题目内容
 室温下,把SiO2超细粉置入蒸馏水中,不断搅拌至平衡,形成 H4SiO4溶液,反应原理如下:SiO2(s)+2H2O(l)?H4SiO4(aq)△H.
室温下,把SiO2超细粉置入蒸馏水中,不断搅拌至平衡,形成 H4SiO4溶液,反应原理如下:SiO2(s)+2H2O(l)?H4SiO4(aq)△H.(1)写出该反应的化学平衡常数K的表达式:
(2)在5~30℃之间,反应平衡常数K随着温度变化如图所示,则△H
(3)实际上,在地球的深处,由于压强很大,固体、液体都会受到影响.在一定温度下,在10000 m以下的地球深处,上述反应移动的方向是
(4)有科学家建议开发硅作为未来的燃料,如果利用氢氧电池把SiO2转化为硅晶体,若能量利用率为75%,则制得1mol硅晶体需要消耗4mol氢气(氢气的燃烧热△H为285.8kJ/mol),请写出硅晶体燃烧的热化学方程式:
(5)硅还原SiO2制SiC,其粗产品中杂质为Si和SiO2,现将20.0gSiC粗产品加入到过量的NaOH溶液处充分反应,收集到0.1mol气体,过滤得SiC固体11.4g,滤液稀释到1L,生成氢气的离子方程式为
考点:化学平衡常数的含义,热化学方程式,化学平衡的影响因素,有关混合物反应的计算
专题:
分析:(1)根据平衡常数表达式的定义书写,但二氧化硅是固体,水是纯液体不代入表达式;
(2)温度升高平衡常数减小,来分析解答;
(3)在压强很大的情况下,压强对固体、液体都会受到影响,所以平衡向体积减小的方向移动;
(4)1mol硅燃烧放出热量为:4mol×285.8kJ/mol×75%=-857.4kJ,由此写出热化学方程式;
(5)硅与氢氧化钠溶液反应生成硅酸钠和氢气,根据硅守恒求硅酸钠的物质的量,然后求硅酸钠的物质的量浓度.
(2)温度升高平衡常数减小,来分析解答;
(3)在压强很大的情况下,压强对固体、液体都会受到影响,所以平衡向体积减小的方向移动;
(4)1mol硅燃烧放出热量为:4mol×285.8kJ/mol×75%=-857.4kJ,由此写出热化学方程式;
(5)硅与氢氧化钠溶液反应生成硅酸钠和氢气,根据硅守恒求硅酸钠的物质的量,然后求硅酸钠的物质的量浓度.
解答:
解:(1)根据平衡常数表达式的定义书写,但二氧化硅是固体,水是纯液体不代入表达式,所以平衡常数K=c(H4SiO4),故答案为:K=c(H4SiO4);
(2)温度升高平衡常数减小,升高温度平衡向逆反应方向移动,所以逆反应是吸热反应,正反应是放热反应,故答案为:<;
(3)在压强很大的情况下,压强对固体、液体都会受到影响,所以平衡向体积减小的方向移动,即正反应方向移动,
故答案为:正方向;在压强很大的情况下,压强对固体、液体都会受到影响,平衡向物质的量少的方向移动;
(4)1mol硅燃烧放出热量为:4mol×285.8kJ/mol×75%=-857.4kJ,所以热化学方程式Si(s)+O2(g)=SiO2(s)△H=-857.4kJ/mol,
故答案为:Si(s)+O2(g)=SiO2(s)△H=-857.4kJ/mol;
(5)硅与氢氧化钠溶液反应生成硅酸钠和氢气,方程式为:Si+2OH-+H2O=SiO32-+2H2↑;收集到0.1mol气体,所以消耗硅的物质的量为0.05mol,此时生成硅酸钠为0.05mol,二氧化硅的物质的量为:
=0.12mol,所以c(Na2SiO3)=
=0.17mol/l,
故答案为:Si+2OH-+H2O=SiO32-+2H2↑;0.17mol/l.
(2)温度升高平衡常数减小,升高温度平衡向逆反应方向移动,所以逆反应是吸热反应,正反应是放热反应,故答案为:<;
(3)在压强很大的情况下,压强对固体、液体都会受到影响,所以平衡向体积减小的方向移动,即正反应方向移动,
故答案为:正方向;在压强很大的情况下,压强对固体、液体都会受到影响,平衡向物质的量少的方向移动;
(4)1mol硅燃烧放出热量为:4mol×285.8kJ/mol×75%=-857.4kJ,所以热化学方程式Si(s)+O2(g)=SiO2(s)△H=-857.4kJ/mol,
故答案为:Si(s)+O2(g)=SiO2(s)△H=-857.4kJ/mol;
(5)硅与氢氧化钠溶液反应生成硅酸钠和氢气,方程式为:Si+2OH-+H2O=SiO32-+2H2↑;收集到0.1mol气体,所以消耗硅的物质的量为0.05mol,此时生成硅酸钠为0.05mol,二氧化硅的物质的量为:
| 20-0.05×28-11.4 |
| 60 |
| (0.05+0.12)mol |
| 1L |
故答案为:Si+2OH-+H2O=SiO32-+2H2↑;0.17mol/l.
点评:本题考查化学平衡常数表达式的书写,平衡的移动、离子方程的书写以及根据方程式计算,难度中等.

练习册系列答案
相关题目
下列表述正确的是( )
| A、人造刚玉熔点很高,可用作高级耐火材料,主要成分是二氧化硅 |
| B、化学家用玛瑙研钵摩擦固体反应物进行无溶剂合成,玛瑙的主要成分是硅酸盐 |
| C、提前建成的三峡大坝使用了大量水泥,水泥是硅酸盐材料 |
| D、夏天到了,游客佩戴由添加氧化亚铜的二氧化硅玻璃制作的变色眼睛来保护眼睛 |
下列各组中属于同位素的是( )
| A、40K与40Ca |
| B、T2O和H2O |
| C、40K与39K |
| D、金刚石与石墨 |
甲、乙是由同主族元素R、Z组成的两种单质,常温下能进行如下反应:甲+乙+H2O--HRO3+HZ(未配平).下列说法正确的是( )
| A、R原子最外层电子数为5 |
| B、单质的氧化性:甲>乙 |
| C、原子半径:R>Z |
| D、HRO3与HZ的计量数比为5:1 |
下列实验装置或操作正确的是( )
A、 烧杯中通入过量的CO2,出现白色沉淀,则溶液中一定含有AlO2- 烧杯中通入过量的CO2,出现白色沉淀,则溶液中一定含有AlO2- |
B、 装置可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、氧化性 装置可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、氧化性 |
C、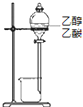 装置可以除去乙醇中的乙酸 装置可以除去乙醇中的乙酸 |
D、 装置可以比较碳酸钠、碳酸氢钠的热稳定性 装置可以比较碳酸钠、碳酸氢钠的热稳定性 |
 ,相对分子质量为116的芳香烃A有如图的转化关系:
,相对分子质量为116的芳香烃A有如图的转化关系: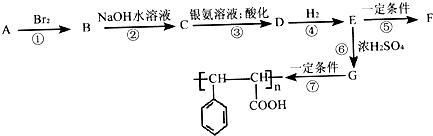
 砷化稼晶体广泛用于太阳能电池、新型光源LED和通讯领域.
砷化稼晶体广泛用于太阳能电池、新型光源LED和通讯领域.
