题目内容
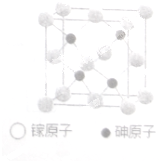 砷化稼晶体广泛用于太阳能电池、新型光源LED和通讯领域.
砷化稼晶体广泛用于太阳能电池、新型光源LED和通讯领域.(1)砷(33As)元素位于元素周期表的第VA族,其原子基态外围电子排布式为
电负性:镓(31As)
第一电离能:砷(33As)
(2)晶体(晶胞结构如图所示)中砷原子的杂化方式为
(3)AsH3分子的空间构型是
①热稳定性:AsH3
②沸点:AsH3
③NH4+离子中H-N-H的键角
考点:元素电离能、电负性的含义及应用,原子核外电子排布,判断简单分子或离子的构型
专题:
分析:(1)确定砷在元素周期表中的位置,然后根据构造原理写出电子排布式;同周期元素从左到右元素的电负性逐渐增强;As和Ga处于同一周期,而处于VA的As外围电子处于半满的较稳定结构,故As的第一电离能大于Ga;
(2)根据砷原子的位置,利用均摊法分析晶胞的结构,确定As的杂化方式;
(3)根据价层电子对数计算杂化类型,确定空间构型;
①元素的非金属性越强其对应的氢化物越稳定;
②NH3含有氢键,沸点最高,AsH3不含氢键;
③根据杂化轨道理论和价层电子对互斥理论,可以分析NH4+中键角大于AsH3中的键角的原因.
(2)根据砷原子的位置,利用均摊法分析晶胞的结构,确定As的杂化方式;
(3)根据价层电子对数计算杂化类型,确定空间构型;
①元素的非金属性越强其对应的氢化物越稳定;
②NH3含有氢键,沸点最高,AsH3不含氢键;
③根据杂化轨道理论和价层电子对互斥理论,可以分析NH4+中键角大于AsH3中的键角的原因.
解答:
解:(1)砷位于元素周期表的第四周期第VA族,外围电子排布为4s24p3,同周期元素从左到右元素的电负性逐渐增强,故电负性:As>Ga,As和Ga处于同一周期,而处于VA的As外围电子处于半满的较稳定结构,故As的第一电离能大于Ga,故答案为:4s24p3;<;>;
(2)根据“均摊法”:白色球个数为6×
+8×
=4,由晶胞图可知与同一个镓原子相连的砷原子构成的空间构型为正四面体,故As的杂化方式为:sp3,答案为:sp3;
(3)AsH3中砷原子有3对成键电子对且1个孤电子对,所以它的杂化方式为sp3,故其空间构型为三角锥,故答案为:三角锥;
①元素的非金属性越强其对应的氢化物越稳定,非金属性:N>As,则稳定性:AsH3<NH3,故答案为:小于;
②NH3含有氢键,沸点最高,AsH3都含氢键,故熔沸点:NH3>AsH3,故答案为:小于;
③根据杂化轨道理论可知NH4+离子中N原子和AsH3分子中的As原子均是按sp3杂化,但氨根中无孤对电子对,而AsH3分子中有1对孤电子对,根据价层电子对互斥理论,AsH3分子中的1对孤电子对对成键电子的斥力更大,所以NH4+离子中键角大于AsH3分子的键角,
故答案为:大于;二者中心原子均为sp3杂化,铵根中无孤电子对,AsH3分子中含有1个孤电子对,对成键电子对的排斥力大.
(2)根据“均摊法”:白色球个数为6×
| 1 |
| 2 |
| 1 |
| 8 |
(3)AsH3中砷原子有3对成键电子对且1个孤电子对,所以它的杂化方式为sp3,故其空间构型为三角锥,故答案为:三角锥;
①元素的非金属性越强其对应的氢化物越稳定,非金属性:N>As,则稳定性:AsH3<NH3,故答案为:小于;
②NH3含有氢键,沸点最高,AsH3都含氢键,故熔沸点:NH3>AsH3,故答案为:小于;
③根据杂化轨道理论可知NH4+离子中N原子和AsH3分子中的As原子均是按sp3杂化,但氨根中无孤对电子对,而AsH3分子中有1对孤电子对,根据价层电子对互斥理论,AsH3分子中的1对孤电子对对成键电子的斥力更大,所以NH4+离子中键角大于AsH3分子的键角,
故答案为:大于;二者中心原子均为sp3杂化,铵根中无孤电子对,AsH3分子中含有1个孤电子对,对成键电子对的排斥力大.
点评:本题考查电负性大小比较、沸点的比较及第一电离能的大小比较、杂化理论等知识,题目难度中等.

练习册系列答案
相关题目
下列有关物质的性质和该性质的应用均正确的是( )
| A、氧化铝熔点高达2045℃,可用于制成坩埚熔化氢氧化钠固体 |
| B、合金大多具有良好的物理、化学或机械性能,可以用于制造货币中的硬币 |
| C、次氯酸具有还原性,可用于自来水的杀菌消毒 |
| D、钠的金属活泼性,钠可以从硫酸铜溶液中置换出金属铜 |
某强酸性溶液X中仅含有NH4+、Al3+、Ba2+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行连续实验,实验过程如下:下列有关推断合理的是( )


| A、根据上述连续实验不能确定溶液X中是否含有Fe3+ |
| B、沉淀H为Al(OH)3、BaCO3的混合物 |
| C、溶液中一定含有H+、Al3+、NH4+、Fe2+、SO42-、Cl- |
| D、若溶液X为100 mL,产生的气体A为112 mL(标况),则X中c(Fe2+)=0.05 mol?L-1 |
 室温下,把SiO2超细粉置入蒸馏水中,不断搅拌至平衡,形成 H4SiO4溶液,反应原理如下:SiO2(s)+2H2O(l)?H4SiO4(aq)△H.
室温下,把SiO2超细粉置入蒸馏水中,不断搅拌至平衡,形成 H4SiO4溶液,反应原理如下:SiO2(s)+2H2O(l)?H4SiO4(aq)△H.