题目内容
8.将有机物完全燃烧,生成CO2和H2O.将12g该有机物完全燃烧后的产物通过浓H2SO4,浓H2SO4增重14.4g,再通过碱石灰,碱石灰增重26.4g.该有机物分子式为C3H8O(写出简要的计算过程)分析 根据浓硫酸和碱石灰增重的质量可计算有机物生成的水和二氧化碳的物质的量,根据C元素、H元素守恒和O元素守恒可计算有机物中C、H、O元素的物质的量,进而计算各元素的物质的量之比,最终可计算有机物的分子式.
解答 解:浓硫酸增重可知水的质量为14.4g,可计算出n(H2O)=$\frac{14.4g}{18g/mol}$=0.8mol,n(H)=1.6mol,m(H)=1.6g;
使碱石灰增重26.4g,可知二氧化碳质量为26.4g,n(C)=n(CO2)=$\frac{26.4g}{44g/mol}$=0.6mol,m(C)=7.2g,m(C)+m(H)=8.8g,
有机物的质量为12g,所以有机物中氧的质量为:12g-8.8g=3.2g,n(O)=$\frac{3.2g}{16g/mol}$=0.2mol,
n(C):n(H):n(O)=0.6mol:1.6mol:0.2mol=3:8:1,即实验式为C3H8O,
由于C3H8O中碳原子已经饱和,所以分子式也为C3H8O,
故答案为:C3H8O.
点评 本题考查了有机物分子式确定的计算,题目难度不大,正确判断有机物燃烧生成水、二氧化碳的量为解答关键,注意掌握守恒思想在化学计算中的应用,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
4.下列指定反应的离子方程式正确的是( )
| A. | FeCl3溶液滴入沸水中制备Fe(OH)3胶体:$Fe_{\;}^{3+}$+$3OH_{\;}^-$═Fe(OH)3(胶体) | |
| B. | Cu溶于稀硝酸:Cu+2$H_{\;}^+$+$NO_3^-$═$Cu_{\;}^{2+}$+NO2↑+H2O | |
| C. | 向苯酚钠溶液中通入少量的CO2:C6H5O-+CO2+H2O→C6H5OH+HCO3- | |
| D. | 氯气溶于水:Cl2+H2O═2H++$Cl_{\;}^-$+$ClO_{\;}^-$ |
13.能证明乙醇分子中有一个羟基的是( )
| A. | 乙醇完全燃烧生成二氧化碳和水 | |
| B. | 乙醇能与水任意比混溶 | |
| C. | 乙醇在铜催化下可被氧化 | |
| D. | 0.1mol乙醇与足量的钠反应只能生成0.1g氢气 |
17.相同物质的量的下列有机物,充分燃烧,消耗氧气量相同的是( )
| A. | C3H4和C2H6 | B. | C2H2和C6H6 | C. | C3H6O和C3H8O2 | D. | C3H8O和C4H8O2 |
18.分析表中的四个热化学方程式,判断氢气和丙烷的燃烧热分别是( )
| “嫦娥一号”发射火箭燃料 | 液氢(H2) | ①2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1 ②2H2(l)+O2(l)═2H2O(g)△H=-482.6kJ•mol-1 |
| 北京奥运会“祥云”火炬燃料 | 丙烷(C3H8) | ③C3H8(l)+5O2(g)═3CO2(g)+4H2O(g)△H=-2013.8kJ•mol-1 ④C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=-2221.5kJ•mol-1 |
| A. | 571.6 kJ•mol-1,2221.5kJ•mol-1 | B. | 241.3 kJ•mol-1,2013.8 kJ•mol-1 | ||
| C. | 285.8 kJ•mol-1,2013.8 kJ•mol-1 | D. | 285.8 kJ•mol-1,2221.5 kJ•mol-1 |
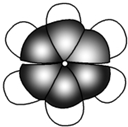 下列给出了四种烃A、B、C、D的相关信息:
下列给出了四种烃A、B、C、D的相关信息: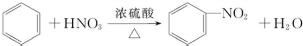 .
. .
.