题目内容
VmLAl2(SO4)3溶液中含Al3-ag,取
mL溶液加水稀释到10VmL,则稀释后溶液中SO42-的物质的量浓度是( )
| V |
| 10 |
A、
| ||
B、
| ||
C、
| ||
D、
|
考点:物质的量浓度的相关计算
专题:
分析:根据n=
计算ag Al3+的物质的量,进而计算
mL溶液中Al3+的物质的量,溶液中n(SO42-)=
n(Al3+),再根据c=
计算稀释后SO42-的物质的量浓度.
| m |
| M |
| V |
| 10 |
| 3 |
| 2 |
| n |
| V |
解答:
解:ag Al3+的物质的量为
=
mol,
mL溶液中Al3+的物质的量为
mol×
,
mL溶液中n(SO42-)=
n(Al3+)=
mol×
×
=
mol,稀释后SO42-的物质的量浓度为
=
mol/L,
故选C.
| ag |
| 27g/mol |
| a |
| 27 |
| V |
| 10 |
| a |
| 27 |
| 1 |
| 10 |
| V |
| 10 |
| 3 |
| 2 |
| a |
| 27 |
| 1 |
| 10 |
| 3 |
| 2 |
| a |
| 180 |
| ||
| 10V×10-3L |
| 5a |
| 9V |
故选C.
点评:本题考查物质的量浓度有关计算,难度不大,注意对化学式意义及物质的量浓度的理解.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
X、Y、Z、W为四种短周期主族元素.其中X、Z同族,Y、Z同周期,W与X、Y既不同族也不同周期;X原子最外层电子数是核外电子层数的3倍;Y的最高正价与最低负价的代数和为6.下列说法正确的是( )
| A、Y元素最高价氧化物对应水化物的化学式为HYO4 |
| B、原子半径由小到大的顺序为:W>X>Z |
| C、Z元素可以形成两种酸性氧化物 |
| D、Y、Z两元素的气态氢化物中,Z的气态氢化物最稳定 |
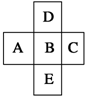 在元素周期表中的前四周期,两两相邻的5种元素如图所示,若B元素的核电荷数为a.下列说法正确的是( )
在元素周期表中的前四周期,两两相邻的5种元素如图所示,若B元素的核电荷数为a.下列说法正确的是( )| A、B、D的原子序数之差可能为2 |
| B、E、B的原子序数之差可能是8、18或32 |
| C、5种元素的核电荷总数之和可能为5a+10 |
| D、A、E的原子序数之差可能是7 |
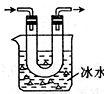
 甲、乙两个实验小组分别进行“测定Na2CO3和NaCl混合物中Na2CO3含量”的实验.
甲、乙两个实验小组分别进行“测定Na2CO3和NaCl混合物中Na2CO3含量”的实验.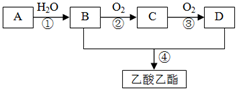 已知:A是石油裂解气的主要成分,A的产量通常用来衡量一个国家的石油化工水平.现以A为主要原料合成乙酸乙酯,其合成路线如图所示.回答下列问题:
已知:A是石油裂解气的主要成分,A的产量通常用来衡量一个国家的石油化工水平.现以A为主要原料合成乙酸乙酯,其合成路线如图所示.回答下列问题: