��Ŀ����
12��һ������50kg�Ľ����ˣ�����Լ����2g������2g���������ڲ����Ե��ʵ���ʽ���ڣ�������Fe2+ ��Fe3+����ʽ���ڣ��������������ױ����գ���ƶѪ�߲�����ʱ��Ӧ���躬Fe2+�������Σ�����������������ά����C����ʹʳ���е�Fe3+��ԭ��Fe2+���������������գ���1�������н���Fe2+$?_{��}^{��}$Fe3+��ת��ʱ�����е�Fe2+����ԭ�������е�Fe3+����������
��2��������ά����C����ʹʳ���е�Fe3+��ԭ��Fe2+����仰ָ����ά����C����һ��Ӧ������ԭ������ά���ؿɸ������ܽ��ԵIJ�ͬ��Ϊ֬����ά���غ�ˮ����ά���������࣬ά����C����ˮ����ά���أ�
��3���г����۵�ij����Ƭ�к������Ŀ���ϸС�Ļ�ԭ���ۣ���Щ����������θ���������ת���������Σ��˷�Ӧ�����ӷ���ʽΪFe+2H+=Fe2++H2����
���� ��1��Ԫ�صĻ��ϼ����ߣ�����ԭ����Ԫ�صĻ��ϼ۽��ͣ�����������
��2��ά����C����ʹʳ���е�Fe3+��ԭ��Fe2+��FeԪ�صĻ��ϼ۽��ͣ�����������ά���ؿɸ������ܽ��ԵIJ�ͬ��Ϊ֬����ά���غ�ˮ����ά���������ࣻ
��3���������ᷴӦ�����Ȼ�������������
��� �⣺��1��Fe2+��Fe3+��ת��ʱ��FeԪ�صĻ��ϼ����ߣ�Fe2+����ԭ����Fe3+��Fe2+ת��ʱ��FeԪ�صĻ��ϼ۽��ͣ�Fe3+����������
�ʴ�Ϊ����ԭ��������
��2��ά����C����ʹʳ���е�Fe3+��ԭ��Fe2+��FeԪ�صĻ��ϼ۽��ͣ�������������ά����C���л�ԭ�ԣ�����ԭ����ά���ؿɸ������ܽ��ԵIJ�ͬ��Ϊ֬����ά���غ�ˮ����ά���������ࣻά����C��ˮ����ά���أ�
�ʴ�Ϊ����ԭ��֬�ܣ�ˮ�ܣ�ˮ�ܣ�
��3������������θ�ᣨ��Ҫ�ɷ�ʱ���ᣩ��������ת���������εĻ�ѧ��ӦΪFe+2H+=Fe2++H2����
�ʴ�Ϊ��Fe+2H+=Fe2++H2����
���� ���⿼��������ԭ��Ӧ��ά����C�����ʺ���;����ȷ������ԭ��Ӧ��Ԫ�صĻ��ϼ۱仯�ǽ����Ĺؼ�������Ϥ������ԭ��Ӧ�еĸ����������Ŀ�ѶȲ���

��ϰ��ϵ�д�
 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
�����Ŀ
17��һ�������£���һ���������ܱ������г��� 2mol SO2 �� 1mol O2���������з�Ӧ��2SO2��g��+O2��g��?2SO3��g�����ﵽƽ���ı�����������SO3 ����ƽ��Ũ�Ȳ��ı���ǣ�������
| A�� | �����¶Ⱥ�����������䣬���� 1 mol SO3��g�� | |
| B�� | �����¶Ⱥ�������ѹǿ���䣬���� 1 mol SO3��g�� | |
| C�� | �����¶Ⱥ�������ѹǿ���䣬���� 1 mol O2��g�� | |
| D�� | �����¶Ⱥ�������ѹǿ���䣬���� l mol Ar��g�� |
4�����в���˵����ѧ���д����Ժ�ʵ���Ե��ǣ�������
| A�� | ��ѧ�ҹ����ô����ϳɰ�������������� | |
| B�� | ��ѧ�Һϳ�̼���ܣ��������ӵ��ߺͳ�С�͵������� | |
| C�� | ������ѧ���Ž��з���Ԫ�������� | |
| D�� | ŵ���������������Ƴ���ըҩ�������ڹ�ҵ���� |
1������˵���в���ȷ���ǣ�������
| A�� | 1 mol �����к���12.04��1023����ԭ�ӣ��ڱ�״����ռ�����22.4 L | |
| B�� | 1 mol������1.5 mol����������ͬ����ԭ���� | |
| C�� | ��״���£�22.4 L H2O�ķ�����Ϊ1NA | |
| D�� | �����ʵ����ĸɱ��������ǣ�C6H12O6��������̼ԭ����֮��Ϊ1��6����ԭ����֮��Ϊ1��3 |
2����һ�������£����Ϊ10L���ܱ������У�1mol X��1mol Y���з�Ӧ��2X��g��+Y��g��?Z��g������60s�ﵽƽ�⣬����0.3mol Z������˵����ȷ���ǣ�������
| A�� | ������ѹǿ��������Y��ת���ʼ�С | |
| B�� | ��XŨ�ȱ仯��ʾ�ķ�Ӧ����Ϊ0.001 mol/��L•s�� | |
| C�� | �������¶ȣ�X���������������÷�Ӧ�ġ�H��0 | |
| D�� | �����������Ϊ20 L��Z��ƽ��Ũ�ȱ�Ϊԭ����1/2 |
 R��g��+S��s���ں��¡��������Ѵﵽƽ����ǣ� ��
R��g��+S��s���ں��¡��������Ѵﵽƽ����ǣ� ��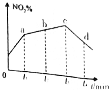 �о��������������ڴ����еĺ������ӵ������ʱ��������·�Ӧ��
�о��������������ڴ����еĺ������ӵ������ʱ��������·�Ӧ��