题目内容
19.PC是一种可降解的聚碳酸酯类高分子材料,由于其具有优良的耐冲击性和韧性,因而得到了广泛的应用.以下是某研究小组开发的生产PC的合成路线:
已知以下信息:
①A可使溴的CCl4溶液褪色;
②B中有五种不同化学环境的氢;
③C可与FeCl3溶液发生显色反应;
④D不能使溴的CCl4褪色,其核磁共振氢谱为单峰.
请回答下列问题:
(1)A的化学名称是(CH3-CH=CH2);
(2)B的结构简式为
 ;
;(3)C与D反应生成E的化学方程式为
 ;
;(4)D有多种同分异构体,其中能发生银镜反应的是CH3CH2CHO(写出结构简式);
(5)B的同分异构体中含有苯环的还有7种,其中在核磁共振氢谱中出现丙两组峰,且峰面积之比为3:1的是
 (写出结构简式).
(写出结构简式).
分析 A可使溴的CCl4溶液褪色,结合A的分子式知,A(C3H6)是丙烯(CH3-CH=CH2);
B中有五种不同化学环境的氢,说明B中有五种等效氢原子,又根据B的分子式C9H12,可推知B为  ;
;
C(C6H6O)可与FeCl3的溶液发生显色反应,结合C的分子式可知C为 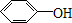 ;
;
D不能使溴的CCl4溶液褪色,其核磁共振氢谱为单峰,说明D中只有一种等效氢原子,则D为丙酮(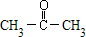 ),故可写出C与D反应生成E的化学方程式为
),故可写出C与D反应生成E的化学方程式为 ,B(C9H12)有多种同分异构体,含有一个取代基时(B除外)有CH2CH2CH3,两个取代基:甲基和乙基在苯环上出现邻、间、对三种结构,三个相同的取代基(三个甲基)有连、偏、均三种形式,即
,B(C9H12)有多种同分异构体,含有一个取代基时(B除外)有CH2CH2CH3,两个取代基:甲基和乙基在苯环上出现邻、间、对三种结构,三个相同的取代基(三个甲基)有连、偏、均三种形式,即  .故含苯环的共有7种;其中在核磁共振氢谱中出现两组峰,且面积之比为3:1的是
.故含苯环的共有7种;其中在核磁共振氢谱中出现两组峰,且面积之比为3:1的是 ,据此分析解答.
,据此分析解答.
解答 解:A可使溴的CCl4溶液褪色,结合A的分子式知,A(C3H6)是丙烯(CH3-CH=CH2);
B中有五种不同化学环境的氢,说明B中有五种等效氢原子,又根据B的分子式C9H12,可推知B为  ;
;
C(C6H6O)可与FeCl3的溶液发生显色反应,结合C的分子式可知C为  ;
;
D不能使溴的CCl4溶液褪色,其核磁共振氢谱为单峰,说明D中只有一种等效氢原子,则D为丙酮(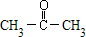 ),故可写出C与D反应生成E的化学方程式为
),故可写出C与D反应生成E的化学方程式为 ,
,
(1)通过以上分析知,A结构简式为(CH3-CH=CH2),为丙烯,故答案为:丙烯;
(2)B中有五种不同化学环境的氢,说明B中有五种等效氢原子,又根据B的分子式C9H12,可推知B为  ,故答案为:
,故答案为: ;
;
(3)C与D反应生成E的化学方程式为 ,故答案为:
,故答案为: ;
;
(4)D为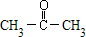 ,D的同分异构体能发生银镜反应说明含有醛基,为丙醛,其结构简式为CH3CH2CHO,
,D的同分异构体能发生银镜反应说明含有醛基,为丙醛,其结构简式为CH3CH2CHO,
故答案为:CH3CH2CHO;
(5)B(C9H12)有多种同分异构体,含有一个取代基时(B除外)有CH2CH2CH3,两个取代基:甲基和乙基在苯环上出现邻、间、对三种结构,三个相同的取代基(三个甲基)有连、偏、均三种形式,即  ,故含苯环的共有7种;其中在核磁共振氢谱中出现两组峰,且面积之比为3:1的是
,故含苯环的共有7种;其中在核磁共振氢谱中出现两组峰,且面积之比为3:1的是 ,
,
故答案为:7; .
.
点评 本题考查有机物推断,为高频考点,侧重考查学生分析推断及知识综合运用能力,明确常见有机物官能团及其性质、物质之间的转化是解本题关键,难点是同分异构体种类判断,题目难度中等.

| A. | v(D)=0.4 mol/(L•min) | B. | v(B)=0.6 mol/(L•min) | ||
| C. | v(C)=0.35 mol/(L•min) | D. | v(A)=0.5 mol/(L•min) |
| A. | 在水溶液里或熔融状态下能够导电的物质叫做电解质 | |
| B. | 微粒直径在10-9 m-10-7m之间的分散系为胶体 | |
| C. | 能够电离出氢离子的化合物叫酸 | |
| D. | 胶体区别于其他分散系的本质特征是具有丁达尔效应 |
| A. | ①②③ | B. | ③②① | C. | ②③① | D. | ②①③ |

实验操作和现象:
| 实验序号 | 操作 | 现象 |
| 实验一 | 关闭弹簧夹,滴加一定量浓硫酸,加热 | A中: (I)加热初期,Cu片表面变黑,溶液近乎无色 (II)继续加热,铜片表面产生气泡,形成黑色浊液,三口瓶底部有灰黑色固体沉积 (III)继续加热,有大量白雾生成,浊液变澄清,三口瓶底部有大量白色固体(因含有极少量黑色固体而显灰白色),Cu片消失B中有气泡冒出,溶液褪色 |
| 实验二 | 停止加热,冷却,将三口瓶中的上清液倒入盛有水的烧杯中 | 三口瓶中留有大量白色固体(因含有极少量黑色固体而显灰白色) 烧杯中溶液温度升高,溶液只略带蓝色 |
(2)三口瓶中的白色固体是CuSO4,验证你这一猜想的实验方案是取少量白色固体溶于水,溶液呈蓝色,说明固体中含有铜离子,向溶液中滴加氯化钡溶液并加入稀盐酸,出现白色沉淀,说明固体中含有硫酸根离子.
(3)A中产生该白色固体的化学方程式是2H2SO4(浓)+Cu$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
(4)结束实验,拆除装置之前,为避免装置中的气体污染环境,应当采取的操作是向A中大量鼓入氮气或空气.
(5)A中产生的大量白雾,甲同学认为是硫酸沸腾后硫酸蒸气与水形成的酸雾.在不改变实验装置的情况下,甲同学设计实验初步证实其想法可能是正确的.甲同学的方案是将品红溶液换为盐酸酸化的氯化钡溶液,实验前先通入一段时间氮气,然后再加入装置A完成实验,若氯化钡溶液中出现白色沉淀,则甲的想法可能是正确的.
(6)有人认为实验过程中A中的黑色固体是CuO,乙同学认为不正确,其理由是CuO+H2SO4=CuSO4+H2O(用化学方程式表示).
(7)为研究A中黑色固体的成分,丙同学猜想其可能含有硫化铜或硫化亚铜.
查阅资料:硫化铜和硫化亚铜常温下均不溶于稀硫酸;在氧气气流中煅烧,均转化为氧化铜和二氧化硫.
丙同学收集到足够的黑色固体后,完成下列实验:

①黑色固体的成分及物质的量是CuS0.001mol、Cu2S0.005mol
②若A中黑色固体与浓硫酸反应能得到澄清的溶液,请写出该反应的化学方程式:5Cu2S+CuS+34H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$11CuSO4+29SO2↑+34H2O.
| A. | Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+H2O | |
| B. | 磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+3H2O | |
| C. | 以铜为电极电解饱和食盐水:2 Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH- | |
| D. | 向含有0.4 mol FeBr2的溶液中通入0.3 mol Cl2充分反应:4 Fe2++2 Br-+3Cl2═4Fe3++6Cl-+Br2 |

 ,F分子中含有的含氧官能团名称是羟基、羧基(顺序可以颠倒).
,F分子中含有的含氧官能团名称是羟基、羧基(顺序可以颠倒). .
. .
. 的合成线路:H2C=CHCH2CH3$\stackrel{HBrO}{→}$HOCH2CHBrCH2CH3→CH3CH2CHBrCOOH$\stackrel{NaOH(aq)△}{→}$CH3CH2CHOHCOOH.
的合成线路:H2C=CHCH2CH3$\stackrel{HBrO}{→}$HOCH2CHBrCH2CH3→CH3CH2CHBrCOOH$\stackrel{NaOH(aq)△}{→}$CH3CH2CHOHCOOH.