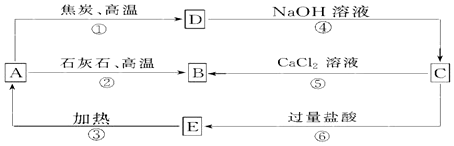
题目内容
18.298K时,向体积均为15.0mL、浓度均为1.00moL/L的氨水和NaHCO3溶液中分别滴加1.00mol/L的盐酸,溶液的pH与所加盐酸体积的关系如图所示.下列有关叙述正确的是( )
| A. | 两个滴定过程均可选择酚酞作指示剂 | |
| B. | 曲线a是NaHCO3溶液的滴定曲线 | |
| C. | 当V(盐酸)=4.00mol/L时,c(HCO3-)>c(NH4+)>c(CO32-) | |
| D. | 当V(盐酸)=15.00mol/L时,c(Na+)=c(NH4+) |
分析 A.强酸弱碱相互滴定时,由于生成强酸弱碱盐使溶液显酸性,所以应选择甲基橙作指示剂;
B.等浓度的氨水和NaHCO3,氨水的电离程度大于HCO3-水解程度,据此进行分析;
C.当V(HCl)=4.00 mL时,浓度均为1.00mol•L-1、体积均为15.00mL的氨水和NaHCO3溶液分别用0.100mol•L-1HCl溶液滴定,分别得到的溶液为NH3•H2O和少量NH4Cl、NaHCO3和少量NaCl;
D.当V(HCl)=15.00 mL时恰好反应,得到溶液为NaHCO3溶液、NaCl溶液,钠离子浓度和铵根离子浓度相同,结合物料守恒分析;
解答 解:A.强酸弱碱相互滴定时,由于生成强酸弱碱盐使溶液显酸性,所以应选择甲基橙作指示剂,所以氨水滴定盐酸需要甲基橙作指示剂,故A错误;
B.等浓度的氨水和NaHCO3,氨水的电离程度大于HCO3-水解程度,故曲线a是氨水溶液的滴定曲线,曲线b是NaHCO3溶液的滴定曲线,故B错误;
C.当V(HCl)=4.00 mL时,浓度均为0.100mol•L-1、体积均为15.00mL的氨水和NaHCO3溶液分别用0.100mol•L-1HCl溶液滴定,分别得到的溶液为NH3•H2O和少量NH4Cl、NaHCO3和少量NaCl,c(HCO3-)>c(NH3•H2O)>c(NH4+)>c(CO32-),故C正确;
D.当V(HCl)=15.00 mL时恰好反应,得到溶液为NaHCO3溶液、NaCl溶液,钠离子浓度和铵根离子浓度相同,c(Na+)=c(NH4+)+c(NH3•H2O),故D错误,
故选C.
点评 本题考查指示剂的选择,电解质溶液中溶质分析、离子浓度大小、物料守恒等知识点,掌握基础是解题关键,题目难度中等.

练习册系列答案
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案
相关题目
9.下列电离方程式书写不正确的是( )
| A. | CaCl2═Ca2++2Cl- | B. | NH3•H2O?NH4++OH- | ||
| C. | CH3COOH═CH3COO-+H+ | D. | H2SO4═2H++SO42- |
6.下列关于碱金属的说法中不正确的是( )
| A. | 铯与水反应比钠更加剧烈 | |
| B. | 原子最外层都只有一个电子 | |
| C. | 锂燃烧生成Li2O | |
| D. | 钾可以将氯化钠溶液中的钠置换出来 |
13.下列关于甲、乙、丙、丁四个图象的说法中,不正确的是( )
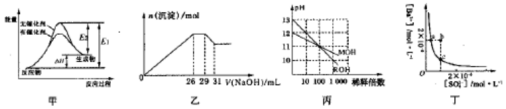

| A. | 若图甲表示某可逆反应的能量变化,说明催化剂能改变正、逆反应的活化能 | |
| B. | 图乙表示在含Mg2+、A13+、NH4+、Cl-的溶液中,加入一定浓度NaOH溶液时生成沉淀的图象,由图可得原溶液中n(Mg2+):n(Al3+):n(NH4+)=10:2:3 | |
| C. | 图丙表示MOH和ROH两种一元碱的溶液分别加水稀释时的pH变化,由图可得碱性:ROH>MOH | |
| D. | 图丁表示某温度时,BaSO4在水中的沉淀溶解平衡曲线,则加入Na2SO4可以使溶 液由a点变到b点 |
10.下列说法正确的是( )
| A. | 需要加热的反应一定是吸热反应 | |
| B. | 不需要加热的反应一定是放热反应 | |
| C. | 停止加热,反应就停止,该反应一定是吸热反应 | |
| D. | 放热反应都会发光并产生火焰 |
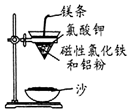 铝热反应是铝的一个重要性质,该性质用途十分广泛,不仅被用于焊接钢轨,而且还常被用于冶炼高熔点的金属如钒、铬、锰等.
铝热反应是铝的一个重要性质,该性质用途十分广泛,不仅被用于焊接钢轨,而且还常被用于冶炼高熔点的金属如钒、铬、锰等. 钛是一种非常优越的金属,尤其是抵抗海水腐蚀的能力很强,被称为继铁、铝之后的第三金属.回答下列问题:
钛是一种非常优越的金属,尤其是抵抗海水腐蚀的能力很强,被称为继铁、铝之后的第三金属.回答下列问题: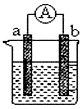 如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:
如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题: